解答题-原理综合题 较难0.4 引用1 组卷133
CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ

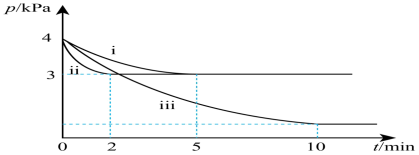
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
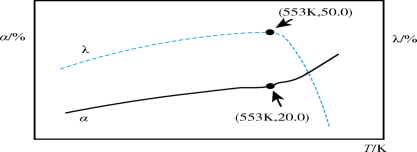
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
下列说法正确的是___________(填序号)。
(3)在25℃和 的条件下,发生反应
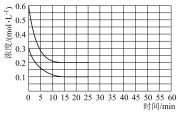
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从 到
到 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从 到
到 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ
反应Ⅲ
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.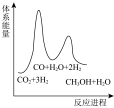 | B.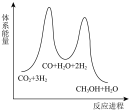 | C. | D. |
(2)向恒温2L容器中充入一定量

下列说法正确的是___________(填序号)。
| A.m点: |
| B. |
| C.活化能:过程Ⅱ<过程Ⅰ |
| D. |
(3)在25℃和
| 压强(Pa) | |||
| 浓度( | 0.08 | 0.20 | 0.44 |
②压强从
(4)在温度
(5)温度为
反应Ⅰ
反应Ⅱ
反应Ⅲ
23-24高二上·湖北武汉·期中
类题推荐
二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

(1)
___________  ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号),判断的理由是___________ 。
A.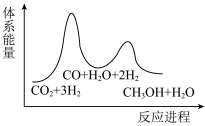 B.
B.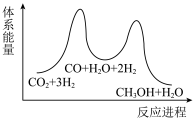
C.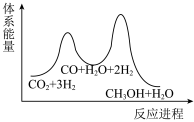 D.
D.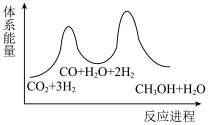
(2)一定条件下,恒容密闭容器中 和
和 发生上述反应。下列说法正确的是___________
发生上述反应。下列说法正确的是___________
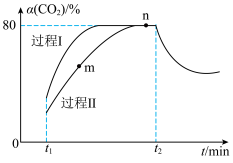
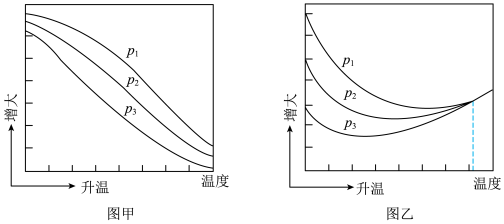
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图___________ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
(4)一定条件下,向体积为1L的恒容密闭容器中通入1mol 和3mol
和3mol  发生上述反应,经10分钟达到平衡,此时
发生上述反应,经10分钟达到平衡,此时 的转化率为80%,且体系中
的转化率为80%,且体系中 。
。 的平均反应速率
的平均反应速率
___________  ,反应Ⅱ的平衡常数K=
,反应Ⅱ的平衡常数K=___________ 。
Ⅰ.
Ⅱ.
Ⅲ.
(1)
A.
 B.
B.
C.
 D.
D.
(2)一定条件下,恒容密闭容器中
| A.当混合气体密度不变时说明体系达到平衡状态 |
| B.反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 |
| C.使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 |
| D.实际生产中温度越低越有利于甲醇的合成 |

已知:
其中纵坐标表示
(4)一定条件下,向体积为1L的恒容密闭容器中通入1mol
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网