解答题-原理综合题 困难0.15 引用1 组卷293
Kvisle等人使用 催化剂研究乙醇转化为1,3-丁二烯的反应机理如下。
催化剂研究乙醇转化为1,3-丁二烯的反应机理如下。
反应Ⅰ: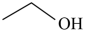 (g)
(g)
 (g)+H2(g)
(g)+H2(g) 
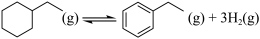
反应Ⅱ: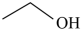 (g)
(g)
 (g)+H2O(g)
(g)+H2O(g) 
反应Ⅲ: (g)+
(g)+  (g)
(g)
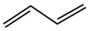 (g)+H2O(g)
(g)+H2O(g) 
(1)在393K,1L恒容密闭容器中进行反应Ⅲ。初始加入0.1mol乙醛和0.1mol乙烯,达平衡时,体系向环境吸热1.3kJ;若初始加入0.4mol 1,3-丁二烯和0.4mol水蒸气,达平衡时,体系向环境放热5.2kJ。忽略副反应热效应,反应Ⅲ焓变
___________  。若反应Ⅲ正反应的活化能为
。若反应Ⅲ正反应的活化能为 ,则反应Ⅲ逆反应的活化能为
,则反应Ⅲ逆反应的活化能为___________  。
。
(2)在393K,上述反应容器中加入1mol乙醛和1mol乙烯只进行反应Ⅲ,下列能说明反应Ⅲ一定达到平衡的是___________ 。
a. (乙醛)
(乙醛) (1,3-丁二烯)
(1,3-丁二烯)
b.混合气体的密度不再发生变化
c.c(乙醛):c(乙烯):c(1,3-丁二烯):c(水蒸气)=1:1:1:1
d.1,3-丁二烯与水蒸气的浓度之比不再发生变化
(3)在393K,向恒容密闭容器中加入5mol乙醇气体,初始压强为 ,同时发生上述3个反应。反应进行2个小时,此时测得容器压强为
,同时发生上述3个反应。反应进行2个小时,此时测得容器压强为 ,则此时乙醇气体的转化率为
,则此时乙醇气体的转化率为___________ 。
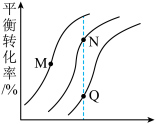
(4)在500K,向恒容密闭容器中加入一定量的乙醇气体,同时发生上述3个反应,混合气体中乙醇、H2、1,3-丁二烯的物质的量分数变化如图所示。图中表示H2的物质的量分数变化的曲线是___________ ,t1时,1,3-丁二烯的产率为___________ (保留三位有效数字)。此温度下,反应Ⅲ的平衡常数
___________ 。平衡后,向该容器中再加入一定量的乙醇气体,1,3-丁二烯的产率___________ (填“增大”、“减小”或“不变”)。

反应Ⅰ:
 (g)
(g) (g)+H2(g)
(g)+H2(g) 反应Ⅱ:
 (g)
(g) (g)+H2O(g)
(g)+H2O(g) 反应Ⅲ:
 (g)+
(g)+  (g)
(g) (g)+H2O(g)
(g)+H2O(g) (1)在393K,1L恒容密闭容器中进行反应Ⅲ。初始加入0.1mol乙醛和0.1mol乙烯,达平衡时,体系向环境吸热1.3kJ;若初始加入0.4mol 1,3-丁二烯和0.4mol水蒸气,达平衡时,体系向环境放热5.2kJ。忽略副反应热效应,反应Ⅲ焓变
(2)在393K,上述反应容器中加入1mol乙醛和1mol乙烯只进行反应Ⅲ,下列能说明反应Ⅲ一定达到平衡的是
a.
b.混合气体的密度不再发生变化
c.c(乙醛):c(乙烯):c(1,3-丁二烯):c(水蒸气)=1:1:1:1
d.1,3-丁二烯与水蒸气的浓度之比不再发生变化
(3)在393K,向恒容密闭容器中加入5mol乙醇气体,初始压强为
(4)在500K,向恒容密闭容器中加入一定量的乙醇气体,同时发生上述3个反应,混合气体中乙醇、H2、1,3-丁二烯的物质的量分数变化如图所示。图中表示H2的物质的量分数变化的曲线是

23-24高三上·山东·阶段练习
类题推荐
Kvisle等人使用MgO=SiO2催化剂研究乙醇转化为1,3-丁二烯的反应机理如下。
②pA(g)+qB(g)⇌mC(g)+nD(g)
 100kPa
100kPa
回答下列问题:
(1)已知:在一定条件下,C2H5OH(g)、CH3CHO(g )⋅CH2=CH2 (g)和CH2=CHCH=CH2 (g)的燃烧热或摩尔燃烧焓(ΔH)分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1和d kJ⋅mol-1,则ΔH ₃=___________ kJ·mol-1,从体系能否自发进行的角度分析,反应Ⅰ在___________ (填“高温”或“低温”)下有利于其自发进行。
(2)向恒温恒容密闭容器中充入等物质的量的C2H5OH(g)和 N2,控制温度为T₁℃、起始压强为10 MPa下发生上述三个反应,反应进行 2 h 达到平衡,测得容器内压强为14 MPa,CH3CHO(g)、CH2=CH2 (g)和CH2=CHCH=CH2 (g)的压强满足以下关系。p(CH3CHO):p(CH2=CH2): p(CH2=CHCH=CH2)=1:3:2,,则1,3-丁二烯的产率为___________ ,反应Ⅲ的平衡常数 
___________
(3)在T2℃、15 MPa反应条件下,向 A、B、C三个容器中通入 分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。
分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。
①当反应进行到20 min时,三个容器中平均反应速率  从大到小的顺序是
从大到小的顺序是___________ 。根据表格中数据可得出的结论是___________ 。
反应I: 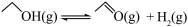 ΔH1=+48kJ/mol
ΔH1=+48kJ/mol
反应II:  ΔH2=-98kJ/mol
ΔH2=-98kJ/mol
反应III: 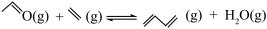 ΔH3
ΔH3
②pA(g)+qB(g)⇌mC(g)+nD(g)
回答下列问题:
(1)已知:在一定条件下,C2H5OH(g)、CH3CHO(g )⋅CH2=CH2 (g)和CH2=CHCH=CH2 (g)的燃烧热或摩尔燃烧焓(ΔH)分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1和d kJ⋅mol-1,则ΔH ₃=
(2)向恒温恒容密闭容器中充入等物质的量的C2H5OH(g)和 N2,控制温度为T₁℃、起始压强为10 MPa下发生上述三个反应,反应进行 2 h 达到平衡,测得容器内压强为14 MPa,CH3CHO(g)、CH2=CH2 (g)和CH2=CHCH=CH2 (g)的压强满足以下关系。p(CH3CHO):p(CH2=CH2): p(CH2=CHCH=CH2)=1:3:2,,则1,3-丁二烯的产率为
(3)在T2℃、15 MPa反应条件下,向 A、B、C三个容器中通入
| 10 min | 20 min | 30 min | 40 min | 50 min | |
| A | 4.1% | 7.8% | 10.9% | 13.8% | 13.8% |
| B | 4.7% | 8.9% | 12.9% | 16.8% | 20.3% |
| C | 5.0% | 9.5% | 13.8% | 17.9% | 21.9% |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

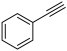
 常用作有机合成与生物化学中间体,可由
常用作有机合成与生物化学中间体,可由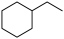 脱氢制得,体系中同时发生如下反应:
脱氢制得,体系中同时发生如下反应: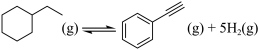
 和1mol H2,达平衡时,体系向环境放热a kJ;若初始加入0.8mol
和1mol H2,达平衡时,体系向环境放热a kJ;若初始加入0.8mol  (g),达平衡时,体系向环境吸热b kJ。则
(g),达平衡时,体系向环境吸热b kJ。则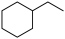 (g),发生反应Ⅰ和反应Ⅱ,测得
(g),发生反应Ⅰ和反应Ⅱ,测得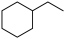 的平衡转化率为
的平衡转化率为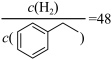 。
。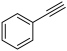 的物质的量为
的物质的量为 的值将(填“增大”“减小”或“不变”)
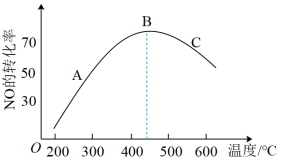
的值将(填“增大”“减小”或“不变”) (g),不同压强和温度下
(g),不同压强和温度下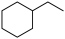 的平衡转化率如图所示。
的平衡转化率如图所示。