填空题 较易0.85 引用1 组卷108
肼(N2H4)是重要的化工原料,能与水、乙醇等混溶;它是一种二元弱碱,在水中的电离方式与氨相似,室温下电离常数 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。
(1)写出N元素在元素周期表中的位置___________ 。
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式___________ 。
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
①写出第二步反应的离子方程式___________ 。
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)___________ 。
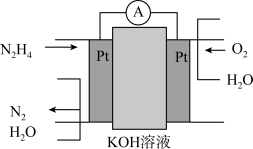
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为___________ 。
(1)写出N元素在元素周期表中的位置
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
①写出第二步反应的离子方程式
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为

23-24高二上·浙江舟山·期中
类题推荐
肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
①工业上合成氨的反应

_______ 
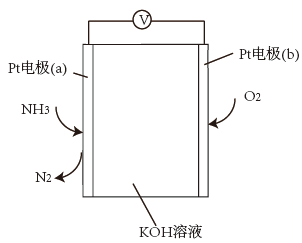
②合成肼的NH3可用电化学气敏传感器监测,原理如图。负极的电极反应为_______ ,假设有16.8L(标准状况)氨气进入传感器,另一极需要通入标准状况下O2的体积为_______ L。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:

写出肼作火箭燃料时反应的热化学方程式_______ 。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;
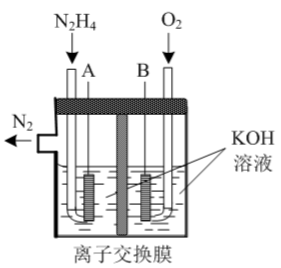
①肼-空气燃料电池的负极反应式为_______ 。
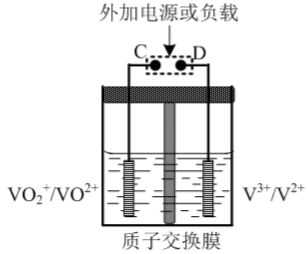
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式_______ 。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是_______ 。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
| 化学键 | |||
| 键能/ | a | b | c |
②合成肼的NH3可用电化学气敏传感器监测,原理如图。负极的电极反应为

(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
写出肼作火箭燃料时反应的热化学方程式
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式

(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是
硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是___________ 。
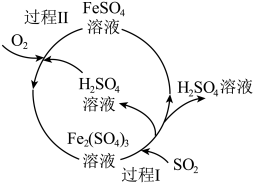
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式___________ ,该工艺流程得到的化工产品是___________ (填化学式)。
(3)25℃时,实验测得NH4HSO3溶液中 =1500,则该溶液的pH为
=1500,则该溶液的pH为___________ (已知25℃时,H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(4)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
(5)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+ N2H
N2H 的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为___________ 。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式

(3)25℃时,实验测得NH4HSO3溶液中
(4)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
| A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B.氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D.氢硫酸的还原性强于亚硫酸 |
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________ ,过氧化氢的电子式为__________________ 。
(2)写出反应的热化学方程式:________________________________________________ 。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
写出表示H2燃烧热的热化学方程式___________________________________________ ;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________ kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________ 。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________ (已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________ 。
(1)肼的电子式为
(2)写出反应的热化学方程式:
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
| O===O | H—H | H—O(g) | |
| 1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式
(4)联氨和H2O2可作为火箭推进剂的主要原因为
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为
 N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


