解答题-原理综合题 适中0.65 引用1 组卷89
“低碳经济”已成为全世界科学家研究的重要课题。其中技术固碳是化学家不断探索的方向,主要应用碳捕集、利用与封存技术。下面是一些利用 为原料制备物质的反应,根据所学知识回答下列问题:
为原料制备物质的反应,根据所学知识回答下列问题:
Ⅰ. 合成尿素的反应为
合成尿素的反应为
 kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。
kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。

(1)若 kJ⋅mol-1,则
kJ⋅mol-1,则
___________ kJ/mol。
(2)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2 mol的 和0.1 mol的
和0.1 mol的 ,若达平衡时等温等容容器中
,若达平衡时等温等容容器中 百分含量为a%,绝热等容容器中
百分含量为a%,绝热等容容器中 百分含量为b%,则a
百分含量为b%,则a___________ b(填“大于”“小于”或“等于”),理由是___________ 。
Ⅱ.在一定条件下 、
、 主要发生以下反应:
主要发生以下反应:
①
 kJ⋅mol-1
kJ⋅mol-1
②
 kJ⋅mol-1
kJ⋅mol-1
向恒压密闭容器中充入物质的量之比为1∶4的 和
和 ,发生上述反应,实验测得
,发生上述反应,实验测得 平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性
平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性 )
)
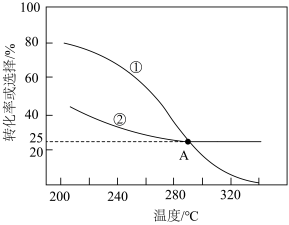
(3)其中表示平衡时 的选择性的曲线是
的选择性的曲线是___________ (填“①”或“②”);A点时 的转化率为
的转化率为___________ (保留小数点后一位)
(4)若在一定温度下,投料比例相同(充入物质的量之比为1∶4的 和
和 ),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为
),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为 ,平衡时
,平衡时 压强为
压强为 ,甲烷压强为
,甲烷压强为 。则甲烷的选择性为
。则甲烷的选择性为___________ (用 、
、 、
、 中相关字母表示,下同),反应②的压强平衡常数
中相关字母表示,下同),反应②的压强平衡常数 的值为
的值为___________ 。
Ⅰ.

(1)若
(2)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2 mol的
Ⅱ.在一定条件下
①
②
向恒压密闭容器中充入物质的量之比为1∶4的

(3)其中表示平衡时
(4)若在一定温度下,投料比例相同(充入物质的量之比为1∶4的
23-24高三上·福建泉州·期中
类题推荐
CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=___________ kJ·mol-1。有利于提高H2平衡转化率的条件是___________ (填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________ (保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
达到平衡时,该反应的平衡常数:K(I)___________ K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________ c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数( )如图所示:
)如图所示:
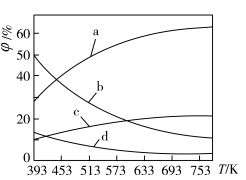
①曲线b、c表示的物质分别为___________ 、___________ (填化学式)。
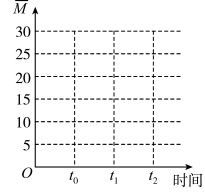
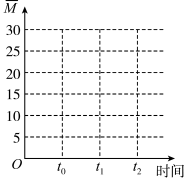
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________ 。
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)
③起始条件(T1℃、2L密闭容器)如表所示:
| CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
| I(恒温恒容) | 2 | 6 | 0 | 0 |
| II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)

①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象

CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ•mol-1和-726.5kJ•mol-1;CH3OH(1)=CH3OH (g) △H=+35.2kJ•mol-1;H2O(1)=H2O(g) △H=+44kJ•mol-1。
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=___ kJ•mol-1。有利于提高H2平衡转化率的条件是___ (填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___ (保留两位小数)。
③起始条件(T1℃、2L密闭容器)如表所示:
达到平衡时,该反应的平衡常数:K(I)___ K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___ c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=-127.8 kJ•mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的体积分数(φ)如图所示:

①曲线b、c表示的物质分别为___ 、___ (填化学式)。
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化趋势图象___ 。
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ•mol-1和-726.5kJ•mol-1;CH3OH(1)=CH3OH (g) △H=+35.2kJ•mol-1;H2O(1)=H2O(g) △H=+44kJ•mol-1。
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
③起始条件(T1℃、2L密闭容器)如表所示:
| CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
| I(恒温恒容) | 2 | 6 | 0 | 0 |
| II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=-127.8 kJ•mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的体积分数(φ)如图所示:

①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化趋势图象

2024年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦二氧化碳的捕捉、利用与封存(CCUS)等问题。回答下列问题:
Ⅰ. 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:
甲烷化反应(主反应):①

逆变换反应(副反应):②

(1)反应③

___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)下列叙述中能说明反应①达到平衡状态的是___________ (填字母)。
A.断裂4mol 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下, 不再变化
不再变化
(3)科研小组按 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是___________ (填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处 的平衡分压为
的平衡分压为___________ MPa(该空忽略副反应逆变换反应)。
反应a:

反应b:

反应c:

由表中数据可知,积碳反应主要由反应___________ 引起(填“a”“b”或“c”)。
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
___________ 。(该反应标准平衡常数的表达式为 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数, )
)
Ⅰ.
甲烷化反应(主反应):①
逆变换反应(副反应):②
(1)反应③
(2)下列叙述中能说明反应①达到平衡状态的是
A.断裂4mol
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下,
(3)科研小组按
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示

| 温度℃ | |||
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |
反应b:
反应c:
由表中数据可知,积碳反应主要由反应
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


