解答题-原理综合题 较难0.4 引用1 组卷62
二甲醚( )被称为“21世纪的清洁燃料”。以
)被称为“21世纪的清洁燃料”。以 、
、 为原料制备二甲醚涉及的主要反应如下:
为原料制备二甲醚涉及的主要反应如下:
Ⅰ.

Ⅱ.

回答下列问题:
(1)反应Ⅰ自发进行的条件是_____ (填“高温”或“低温”)。
(2)已知 、
、 下,
下, 、
、 的燃烧热分别为:
的燃烧热分别为: 、
、 ,
,
 ,则
,则
_____  。
。
(3)保持压强为 ,按
,按 投料,发生反应Ⅰ、Ⅱ,实验测得
投料,发生反应Ⅰ、Ⅱ,实验测得 平衡转化率和平衡时
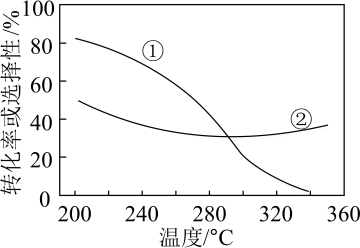
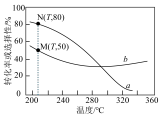
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
已知: 的选择性
的选择性
① 时向平衡体系中充入一定量的Ar,M点位置
时向平衡体系中充入一定量的Ar,M点位置_____ (填“上移”“下移”或“不变”),原因是_____ 。
② 时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
_____ 。则该时间段 的平均速率为
的平均速率为_____  (保留小数点后两位)。
(保留小数点后两位)。
③表示平衡时 的选择性的是曲线
的选择性的是曲线_____ (填“a”或“b”);温度低于 时,曲线b随温度升高而降低的原因是
时,曲线b随温度升高而降低的原因是_____ ;
Ⅰ.
Ⅱ.
回答下列问题:
(1)反应Ⅰ自发进行的条件是
(2)已知
(3)保持压强为
已知:
①

②
③表示平衡时
23-24高二上·辽宁朝阳·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网