解答题-原理综合题 较难0.4 引用1 组卷598
我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。异丁烯
转化为高附加值化学品成为科学家研究的重要课题。异丁烯 作为汽油添加剂的主要成分,可利用异丁烷与
作为汽油添加剂的主要成分,可利用异丁烷与 反应来制备。
反应来制备。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)已知:异丁烷、异丁烯、 的燃烧热热化学方程式的焓变分别为
的燃烧热热化学方程式的焓变分别为 ,则
,则
_______ (用题目给的反应焓变来表示)。
(2)向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,利用反应Ⅰ制备异丁烯。已知
,利用反应Ⅰ制备异丁烯。已知 ;正反应速率表示为
;正反应速率表示为 ,逆反应速率表示为
,逆反应速率表示为 ,其中
,其中 、
、 为速率常数。
为速率常数。
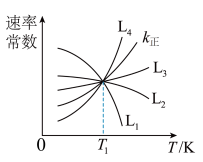
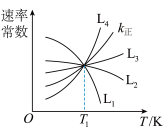
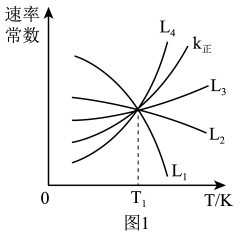
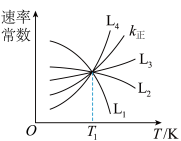
①图中能够代表 的曲线为
的曲线为_______ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
②温度为 时,该反应化学平衡常数
时,该反应化学平衡常数
_______ ,平衡时 转化率
转化率_______ 50%(填“>”“=”或“<”)。
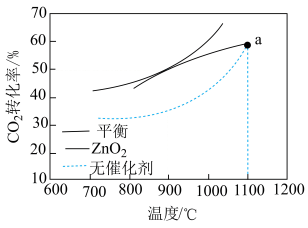
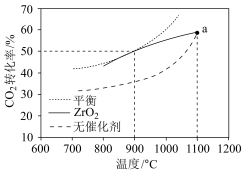
(3) 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在
。在 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂及
充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
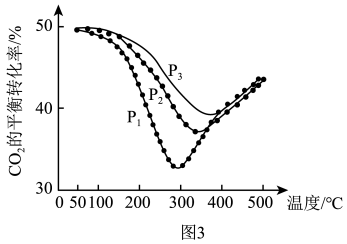
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:

①a点时有催化剂和无催化剂的 转化率相等的原因是
转化率相等的原因是_______ 。
②在 催化条件下,将
催化条件下,将 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为a,此时平衡常数
的平衡转化率为a,此时平衡常数
_______ (以分压表示,分压=总压×物质的量分数;用含a、n、p的代数式表示)。
(4)相比于反应Ⅱ直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应 ,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是
,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是_______ 。
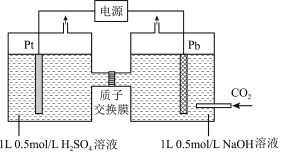
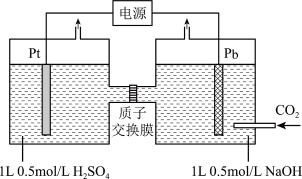
(5)利用电化学可以将 有效转化为
有效转化为 ,装置如图所示(忽略电解前后溶液的体积变化):
,装置如图所示(忽略电解前后溶液的体积变化):
①已知:电解效率 。装置工作时,阴极除有
。装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为 时,测得整个阴极区内的
时,测得整个阴极区内的 ,电解效率为
,电解效率为_______ 。
②研究表明,溶液 会影响
会影响 转化为
转化为 的效率。如图是
的效率。如图是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随
计)在水溶液中各种存在形式的物质的量分数δ随 变化的情况。
变化的情况。
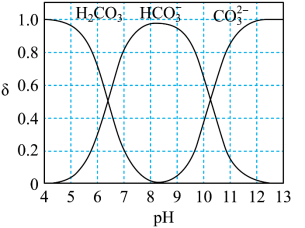
 时,
时, 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为_______ ;在此条件下装置工作一段时间后,阴极附近溶液的
_______ (填标号:a.明显增大b.几乎不发生变化c.明显减小)。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)已知:异丁烷、异丁烯、
(2)向
①图中能够代表

②温度为
(3)

①a点时有催化剂和无催化剂的
②在
(4)相比于反应Ⅱ直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应
(5)利用电化学可以将

①已知:电解效率
②研究表明,溶液

23-24高三上·全国·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网