解答题-实验探究题 适中0.65 引用2 组卷140
课本上中和热的测定实验通常选用等体积浓度分别为 盐酸和
盐酸和 溶液,但
溶液,但 易吸收空气中的
易吸收空气中的 ,为了配制不含
,为了配制不含 的
的 溶液,可先将
溶液,可先将 配成饱和溶液,待沉淀后在量取一定量的上层清液,稀释至所需浓度。用上述方法配制的氢氧化钠溶液的浓度仍然是未知的,需用基准物质来标定。常用邻苯二甲酸氢钾
配成饱和溶液,待沉淀后在量取一定量的上层清液,稀释至所需浓度。用上述方法配制的氢氧化钠溶液的浓度仍然是未知的,需用基准物质来标定。常用邻苯二甲酸氢钾 滴定测出氢氧化钠溶液的浓度。
滴定测出氢氧化钠溶液的浓度。
(已知:邻苯二甲酸的 ,
, )
)
(1)滴定时邻苯二甲酸氢钾溶液装在___________ (填“酸式”或“碱式”)滴定管中,结合数据说明理由___________ 。
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):___________ 。
检漏→蒸馏水洗涤→(_______)→(_______)→(_______)→(_______)→(________)→开始滴定
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)该滴定实验中选择___________ 指示剂(填字母)。
A.甲基橙 B.酚酞 C.石蕊
滴定终点的现象是___________ 。
(4)数据处理
依据表中数据计算该氢氧化钠溶液的物质的量浓度___________  (保留四位小数)。
(保留四位小数)。
(5)围绕该实验下列说法正确的是___________。
(已知:邻苯二甲酸的
(1)滴定时邻苯二甲酸氢钾溶液装在
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→(_______)→(_______)→(_______)→(_______)→(________)→开始滴定
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)该滴定实验中选择
A.甲基橙 B.酚酞 C.石蕊
滴定终点的现象是
(4)数据处理
| 滴定次数 | 待测 | ||
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 2.00 | 22.91 |
| 第二次 | 20.00 | 1.56 | 20.30 |
| 第三次 | 20.00 | 0.22 | 21.31 |
(5)围绕该实验下列说法正确的是___________。

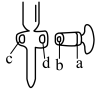
| A.为防止活塞漏水需在活塞处涂凡士林,如图所示应涂bd处 |
| B.实验测出的氢氧化钠溶液的物质的量浓度与实际配成所需浓度有偏差,可能是因为取待测液时滴定管没有用待测液润洗 |
| C.读数时应该手拿滴定管上端无溶液处,使滴定管自然下垂。 |
| D.锥形瓶中变色后立即读数 |
23-24高二上·浙江杭州·期中
类题推荐
某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入 溶液滴定,发生反应:
溶液滴定,发生反应:
 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
1.称取
Ⅱ.取
Ⅲ.向Ⅱ的锥形瓶中加入
Ⅳ.平行测定四次,四次滴定实验消耗
| 滴定次数 | 待测溶液的体积/ | ||
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
(1)盛装

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
(4)滴定终点的现象
(5)Ⅳ所消耗的
(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
某食用白醋是由醋酸与纯水配制而成,科技活动周中某同学拟用学过的酸碱中和滴定知识来测定其中醋酸的物质的量浓度。已知标准液c(NaOH)=0.1020mol/L。
(1)查阅白醋包装:醋酸含量约为6g/100mL,换算成物质的浓度约为_______  ,滴定前要先将白醋稀释10倍。
,滴定前要先将白醋稀释10倍。
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→_______ →开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用洗耳球吹出润洗液 E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
(3)准确量取稀释后的白醋25.00mL,置于锥形瓶中,用_______ 作指示剂,当上述NaOH标准溶液滴定至_______ 即为终点。
(4)为了减小实验误差,该同学一共进行了三次实验,三次实验结果记录如下:
(5)根据所给数据,计算该品牌白醋中醋酸的物质的量浓度:_______ 。
(1)查阅白醋包装:醋酸含量约为6g/100mL,换算成物质的浓度约为
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用洗耳球吹出润洗液 E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
(3)准确量取稀释后的白醋25.00mL,置于锥形瓶中,用
(4)为了减小实验误差,该同学一共进行了三次实验,三次实验结果记录如下:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 21.40 |
| 第二次 | 25.00 | 2.50 | (见图) |
| 第三次 | 25.00 | 1.20 | 21.10 |
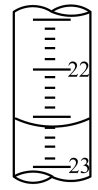
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗 |
| C.第一次滴定用的锥形瓶未润洗 |
| D.滴定结束时,俯视读数 |
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序___________ 。
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:___________ 。
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为___________ mL。
(5)某学生根据三次实验分别记录有关数据如表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度:c(NaOH)=___________ mol/L。(计算结果保留4位有效数字)
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为

A. | B.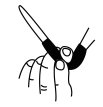 | C. | D. |
(5)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.锥形瓶用待测液润洗 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


