解答题-工业流程题 较难0.4 引用1 组卷217
智能手机因其集成的高清摄像头和智能传感器而常被应用于化学实验。某实验小组利用实验室中的废铁屑(久置但未生锈)制备硝酸铁,并利用配制的硝酸铁标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定。
已知: 溶液有强氧化性,浓度越大,氧化性越强。
溶液有强氧化性,浓度越大,氧化性越强。
实验过程如下:
实验I: 的制备
的制备
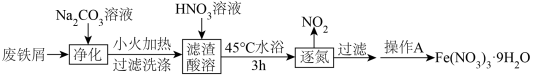
(1)实验室中保存 溶液时,往往加入少许
溶液时,往往加入少许_______ ,目的是_______ 。请简述验证 溶液被部分氧化的实验过程和现象
溶液被部分氧化的实验过程和现象_______ 。
(2)经推测,逐氮过程中的 气体,是
气体,是 发生了分解,写出该反应的化学方程式:
发生了分解,写出该反应的化学方程式:_______ 。
(3)操作A包含的实验步骤有:_______ 、_______ 、过滤、洗涤、干燥。
实验Ⅱ:标准硝酸铁溶液的配制
准确称取 的
的 按如图步骤配成
按如图步骤配成 溶液。
溶液。
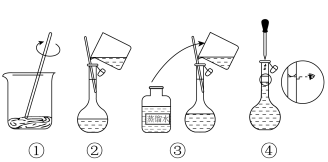
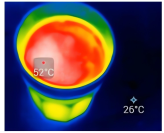
(4)智能手机连接热成像配件FLIROnePro可即时测定过程①中溶液温度。若将如图溶解所得溶液立即转移至容量瓶中并进行定容,则上述操作会导致配得溶液浓度_______ (填“偏高”、“偏低”或“无影响”)。
实验Ⅲ:绘制标准 溶液与灰度值的标准曲线
溶液与灰度值的标准曲线
①分别向7个 容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0
容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0 实验Ⅱ中标定的浓度为
实验Ⅱ中标定的浓度为 的
的 标准溶液,然后分别加入
标准溶液,然后分别加入 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
②将配好的溶液加入到 比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:
比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:

(5)上述实验中,根据合理数据处理得
_______ (保留1位有效数字)。
实验V:“硫酸亚铁补铁剂中铁元素含量的测定
①取补铁剂样品 ,加入
,加入 蒸馏水完全溶解,再加入足量
蒸馏水完全溶解,再加入足量 溶液,充分反应后配成
溶液,充分反应后配成 溶液。
溶液。
②取 ①中所配溶液于
①中所配溶液于 容量瓶中,加入
容量瓶中,加入 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
将最终配好的溶液加入到 比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。
比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。
(6)“硫酸亚铁补铁剂”中铁元素的质量分数为_______  (保留2位有效数字)。
(保留2位有效数字)。
(7)下列操作中有利于更准确测得“硫酸亚铁补铁剂中的铁元素含量的有_______。
已知:
实验过程如下:
实验I:

(1)实验室中保存
(2)经推测,逐氮过程中的
(3)操作A包含的实验步骤有:
实验Ⅱ:标准硝酸铁溶液的配制
准确称取

(4)智能手机连接热成像配件FLIROnePro可即时测定过程①中溶液温度。若将如图溶解所得溶液立即转移至容量瓶中并进行定容,则上述操作会导致配得溶液浓度

实验Ⅲ:绘制标准
①分别向7个
②将配好的溶液加入到
| 比色管编号 | S0 | S1 | S2 | S3 | S4 | S5 | S6 |
| 0 | 0.5 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | |
| 0 | 0.0001 | 0.0002 | 0.0004 | 0.0006 | 0.0008 | 0.001 | |
| 灰度值 | 127.3 | 119.4 | 107.1 | 87.3 | 65.3 | 47.2 | 29.2 |

(5)上述实验中,根据合理数据处理得
实验V:“硫酸亚铁补铁剂中铁元素含量的测定
①取补铁剂样品
②取
将最终配好的溶液加入到
(6)“硫酸亚铁补铁剂”中铁元素的质量分数为
(7)下列操作中有利于更准确测得“硫酸亚铁补铁剂中的铁元素含量的有_______。
| A.提前除去实验I溶解铁屑所用硝酸中的 |
| B.用浓硝酸溶液代替实验Ⅳ中所用的 |
| C.整个实验中所用的 |
| D.将配制的样品溶液和7个标准溶液放在一起在相同条件下同时拍照,再统一进行数据处理 |
23-24高一上·陕西西安·阶段练习
类题推荐
某小组以废铁屑(久置但未生锈)为原料制备Fe(NO3)3,并利用配制的Fe(NO3)3标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定,实验过程如下:
【实验Ⅰ】Fe(NO3)3·9H2O的制备___________ ;稀硝酸要足量的目的有:①确保铁元素转化成Fe3+,②___________ 。
(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、___________ 。
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
___________ ,b=___________ 。
【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为___________ %。
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
【实验Ⅰ】Fe(NO3)3·9H2O的制备

(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
| A.溶液未恢复室温就注入容量瓶定容 |
| B.定容时俯视液面 |
| C.摇匀后发现液面低于刻度线,于是加水至刻度线 |
| D.容量瓶底部残留少量的蒸馏水而未做干燥处理 |
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
| 比色管编号 | S1 | S2 | S3 | S4 | S₅ | S6 |
| Fe(NO3)3溶液/mL | 0.50 | 0.75 | 1.00 | 1.25 | 1.50 | 2.00 |
| c(Fe3+)/(10-4mol·L-1) | 1 | 1.5 | 2 | 2.5 | 3 | 4 |
| 吸光度A | 0.12 | 0.17 | 0.22 | 0.27 | 0.32 | 0.42 |

【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
| A.提前除去【实验Ⅰ】溶解铁屑所用硝酸中的Fe3+杂质 |
| B.用浓硝酸溶液代替【实验Ⅳ】中所用的H2O2溶液 |
| C.整个实验中均采用相同浓度的KSCN溶液 |
| D.对每一份溶液平行测定多次吸光度A,取平均值作结果 |
作为长沙的传统小吃,臭豆腐深受市民喜爱,而用硫酸亚铁着色是长沙臭豆腐制作的传统工艺。在发酵过程中硫酸亚铁发生自然反应,从而使臭豆腐变成黑色,按照国家标准使用并无危害。某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下:
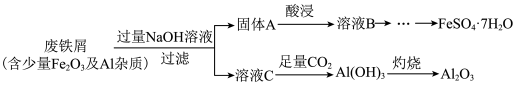
请回答下列问题:
(1)溶液C中的溶质为___________ (填化学式)。
(2)“酸浸”时需加入试剂的化学式为___________ ,请写出该过程中属于非氧化还原反应的离子方程式:___________ 。
(3)“灼烧”操作选择下列哪一种仪器最合适___________(填字母)。
(4)请设计实验方案检验溶液B中含有Fe2+:___________ 。
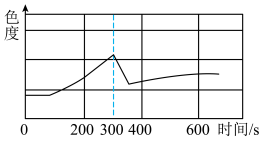
(5)下图为某浓度FeSO4溶液放置在空气中时的色度随时间变化的图象(溶液的颜色越深,色度越大)。其中在第300s时加入了一定量的维生素C溶液。则维生素C使溶液色度下降的原因是___________ 。
(6)该实验需要用到0.5mol/L NaOH溶液240mL,现用固体NaOH进行配制。
①配制时需用托盘天平称量___________ g NaOH固体。
②下列说法正确的是___________ (填字母)。
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中,然后缓慢加水至刻度线1-2cm处,再滴加蒸馏水至刻度线
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有Na2O杂质,会导致所配溶液的浓度偏高

请回答下列问题:
(1)溶液C中的溶质为
(2)“酸浸”时需加入试剂的化学式为
(3)“灼烧”操作选择下列哪一种仪器最合适___________(填字母)。
A. | B.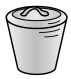 | C. | D.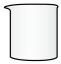 |
(4)请设计实验方案检验溶液B中含有Fe2+:
(5)下图为某浓度FeSO4溶液放置在空气中时的色度随时间变化的图象(溶液的颜色越深,色度越大)。其中在第300s时加入了一定量的维生素C溶液。则维生素C使溶液色度下降的原因是

(6)该实验需要用到0.5mol/L NaOH溶液240mL,现用固体NaOH进行配制。
①配制时需用托盘天平称量
②下列说法正确的是
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中,然后缓慢加水至刻度线1-2cm处,再滴加蒸馏水至刻度线
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有Na2O杂质,会导致所配溶液的浓度偏高
小蔡同学有点缺铁性贫血,他看中了市面上的一款“SP补铁剂”,产品说明书如图。但他为人谨慎,想通过实验验证产品说明书是否属实,再购买和使用。

【查阅资料】 易被空气中的氧气氧化为
易被空气中的氧气氧化为 。
。
实验一:检验补铁剂中是否含
(1)具体的实验操作为:________________ 。
实验二:测定补铁剂中铁元素的含量
【实验原理】用一定浓度的酸性高锰酸钾标准溶液滴定补铁剂,即可测定 的含量。
的含量。
I.配制100mL 的酸性
的酸性 标准溶液
标准溶液
(2)用电子天平(可精确到0.001g)称取的 的质量为
的质量为______ 。
(3)配制上述溶液,所需的仪器有电子天平、药匙、量筒、烧杯、玻璃棒、______ 。
(4)下列配制溶液的操作中,正确的是______(填序号)。
(5)下述操作,将导致所得的标准溶液浓度偏低的是_____(填序号)。
II.用移液管量取10.00mL补铁剂,用所配制的酸性 标准溶液滴定补铁剂,测定
标准溶液滴定补铁剂,测定 的含量。滴定过程中,平均消耗12.00mL酸性
的含量。滴定过程中,平均消耗12.00mL酸性 标准溶液。
标准溶液。
已知滴定过程中涉及的反应的离子方程式为:
(6)高锰酸钾在水中的电离方程式为:__________________ 。
(7)根据实验结果,补铁剂中 的浓度为
的浓度为______ mg/mL。
(8)小蔡同学发现, 的含量小于说明书中的50mg/mL,你猜测原因可能是
的含量小于说明书中的50mg/mL,你猜测原因可能是____________ 。
【进一步探究】小蔡同学取滴定后的一份溶液,往溶液中滴加过量氢氧化钠溶液,将所得沉淀过滤出来,洗涤,灼烧,得到0.57g固体。
已知灼烧过程中涉及的化学方程式为:
(9)往溶液中加入过量氢氧化钠溶液的离子方程式为:__________________ 。
【得出结论】
(10)“SP补铁剂”中,实际的铁元素含量______ 说明书中的铁元素含量(填“大于”、“小于”或“等于”)。

【查阅资料】
实验一:检验补铁剂中是否含
(1)具体的实验操作为:
实验二:测定补铁剂中铁元素的含量
【实验原理】用一定浓度的酸性高锰酸钾标准溶液滴定补铁剂,即可测定
I.配制100mL
(2)用电子天平(可精确到0.001g)称取的
(3)配制上述溶液,所需的仪器有电子天平、药匙、量筒、烧杯、玻璃棒、
(4)下列配制溶液的操作中,正确的是______(填序号)。
| A.将高锰酸钾固体放入烧杯中,量取约20mL水进行溶解,并加入适量稀硫酸酸化 |
| B.待酸性 |
| C.酸性 |
| D.将液摇匀后发现液面低于刻度线,用胶头滴管补加蒸馏水至刻度线处 |
| A.所使用的容量瓶未经干燥,含有蒸馏水 |
| B.未经冷却就将溶液转移至容量瓶中定容 |
| C.定容时仰视刻度线 |
| D.洗涤玻璃棒和烧杯时,有液体溅出 |
II.用移液管量取10.00mL补铁剂,用所配制的酸性
已知滴定过程中涉及的反应的离子方程式为:
(6)高锰酸钾在水中的电离方程式为:
(7)根据实验结果,补铁剂中
(8)小蔡同学发现,
【进一步探究】小蔡同学取滴定后的一份溶液,往溶液中滴加过量氢氧化钠溶液,将所得沉淀过滤出来,洗涤,灼烧,得到0.57g固体。
已知灼烧过程中涉及的化学方程式为:
(9)往溶液中加入过量氢氧化钠溶液的离子方程式为:
【得出结论】
(10)“SP补铁剂”中,实际的铁元素含量
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


