解答题-原理综合题 适中0.65 引用2 组卷90
(1)①
②
(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
| 酸 | ||||
| A.用浓硫酸和氯化钠固体加热制氯化氢是因为在水中硫酸的酸性比盐酸的酸性强 |
| B.冰醋酸中可以发生反应: |
| C.冰醋酸中 |
| D.向硫酸的冰醋酸溶液中加入 |
①
②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是
23-24高二上·浙江·阶段练习
类题推荐
I. 是一种常见的酸,
是一种常见的酸, ,可以形成多种醋酸盐。回答下列问题:
,可以形成多种醋酸盐。回答下列问题:
(1)在室温下, 醋酸钠溶液的
醋酸钠溶液的 约为
约为___________ 。
(2)在室温下,若下列溶液的物质的量浓度相同:① ②
② ③
③ ④
④ ,则
,则 从大到小的顺序为
从大到小的顺序为___________ 。
(3)在室温下,等物质的量浓度的 与
与 以体积比
以体积比 混合,混合后溶液的
混合,混合后溶液的 ,求
,求
___________ (写出计算结果的表达式)。
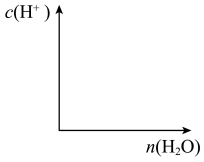
(4)冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加, 的变化曲线
的变化曲线__________ 。
II.已知次磷酸 是一种一元弱酸;电离平衡常数
是一种一元弱酸;电离平衡常数 。
。
(5)写出次磷酸与足量 反应的离子方程式
反应的离子方程式___________ 。
(6)下列说法正确的是___________(填字母)。
(1)在室温下,
(2)在室温下,若下列溶液的物质的量浓度相同:①
(3)在室温下,等物质的量浓度的
(4)冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加,

II.已知次磷酸
(5)写出次磷酸与足量
(6)下列说法正确的是___________(填字母)。
| A.导电能力 |
| B. |
| C. |
| D.常温下, |
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的四种溶液:
A. B.
B.  C.
C.  D.
D.  ,其pH由大到小的顺序是
,其pH由大到小的顺序是_________ (填编号)。
②将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是__________ 。
③用0.1mol/L 滴定20mL 0.1mol/L NaOH溶液的滴定曲线如图所示
滴定20mL 0.1mol/L NaOH溶液的滴定曲线如图所示
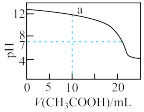
则a点溶液中
______  (填“
(填“ ”“
”“ ”或“=”)。
”或“=”)。
④已知在比较酸的强弱时,需要考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如 在水中是强酸,在冰醋酸中就是弱酸;而
在水中是强酸,在冰醋酸中就是弱酸;而 在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:
在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力: 。下列关于酸性强弱的说法正确的是
。下列关于酸性强弱的说法正确的是_________ 。
A. 在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙
B. 比较 、
、 、
、 、
、 酸性的强弱,用水肯定不可以,用冰醋酸可能可以
酸性的强弱,用水肯定不可以,用冰醋酸可能可以
C. 在冰醋酸中, 的电离方程式为:
的电离方程式为:
D. 比较 与
与 酸性的强弱,用水肯定可以,用液氨肯定可以
酸性的强弱,用水肯定可以,用液氨肯定可以
(2)某温度下, 的盐酸中
的盐酸中 mol/L。该温度下,
mol/L。该温度下, 的
的 与
与 的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为
的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为_______ 。
(3)在 溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为
溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为__ ;该二元弱酸的一级电离常数为 ,则
,则
______ 。

(4)欲用5L 溶液将23.3g
溶液将23.3g 固体全部转化为
固体全部转化为 ,则所用的
,则所用的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为______ 。已知 、
、 (忽略溶液体积变化)
(忽略溶液体积变化)
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCN | |||
| 电离常( |
①常温下,物质的量浓度相同的四种溶液:
A.
②将少量
③用0.1mol/L

则a点溶液中
④已知在比较酸的强弱时,需要考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如
A. 在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙
B. 比较
C. 在冰醋酸中,
D. 比较
(2)某温度下,
(3)在

(4)欲用5L
下表是几种常见弱酸的电离平衡常数 ,回答下列各题:
,回答下列各题:
(1)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是_______ 、_______ (用化学式表示),
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是_______ (填序号),
A.升高温度 B.加水稀释
C.加少量的 固体 D.加少量冰醋酸
固体 D.加少量冰醋酸
E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______ 。
(2)已知草酸 是一种二元弱酸,其电离常数
是一种二元弱酸,其电离常数 ,
, ,试从电离平衡移动的角度解释
,试从电离平衡移动的角度解释 的原因
的原因_______ 。
| 酸 | ||||
| 电离平衡常数 |
①上述四种酸中,酸性最弱、最强的酸分别是
②下列能使醋酸溶液中
A.升高温度 B.加水稀释
C.加少量的
E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(2)已知草酸
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


