解答题-实验探究题 较难0.4 引用4 组卷670
氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
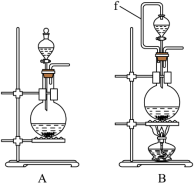
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
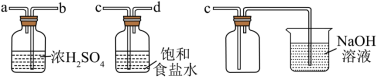
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。

(1)实验室沿用舍勒的方法制取

(2)实验室制取干燥、纯净的

(3)反应停止后,实验小组检验烧瓶中还有
【提出猜想】
猜想1:
猜想2:
猜想3:
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸, | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 | 猜想3正确 |
23-24高一上·全国·期末
类题推荐
回答下列问题。
I.元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,①⑧分别代表一种元素。回答下列问题:
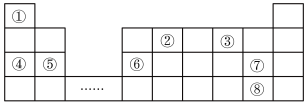
(1)元素②在元素周期表的位置为___________ ;元素②、③形成的化合物___________ (填“属于”或“不属于)电解质。
(2)元素①和③形成原子个数比为 的氢化物,写出它的电子式:
的氢化物,写出它的电子式:___________ 。
(3)元素③、⑤、⑦形成的简单离子半径由大到小的顺序为___________ (用离子符号填空)。
Ⅱ.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,请回答下列问题:
实验室沿用舍勒的方法制取 ,反应停止后,实验小组检验烧瓶中还有
,反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
(4)【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂___________ (填化学式)氧化性减弱。
猜想2:___________ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
(5)利用氯气与潮湿的消石灰反应制取少量漂白粉。消石灰足量时,通入标准状况下 ,制得漂白粉中有效成分
,制得漂白粉中有效成分 的质量为
的质量为 ,则
,则 制取
制取 的产率为
的产率为___________ 。
I.元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,①⑧分别代表一种元素。回答下列问题:

(1)元素②在元素周期表的位置为
(2)元素①和③形成原子个数比为
(3)元素③、⑤、⑦形成的简单离子半径由大到小的顺序为
Ⅱ.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,请回答下列问题:
实验室沿用舍勒的方法制取
(4)【提出猜想】
猜想1:
猜想2:
猜想3:
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸, | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 | 猜想3正确 |
(5)利用氯气与潮湿的消石灰反应制取少量漂白粉。消石灰足量时,通入标准状况下
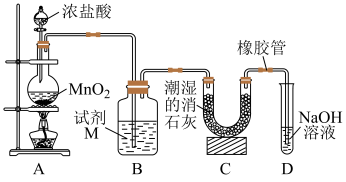
某小组用MnO2与浓盐酸混合共热制备氯气。
(1)反应的离子方程式是_______ 。
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为_______ 。
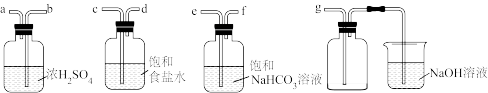
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂_______ (填氧化剂化学式)氧化性减弱。
猜想b:在此反应中,_______ 减弱。
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
⑤数据分析,得出结论 猜想a、猜想b和猜想c均正确。
⑥迁移应用 25℃时, 。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:
。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:_______ 。
(1)反应的离子方程式是
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为
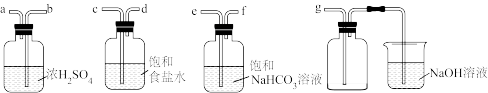
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂
猜想b:在此反应中,
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
| 实验序号 | 操作 | 有无氯气生成 |
| 1 | 加入较浓硫酸,使 | 有氯气 |
| 2 | 加入NaCl固体,使 | 有氯气 |
| 3 | 无氯气 |
⑥迁移应用 25℃时,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网