解答题-工业流程题 较难0.4 引用1 组卷92
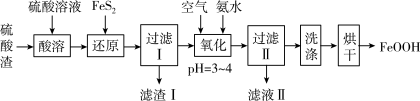
以高硫铝土矿(主要成分为 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
( )的工艺流程如图:
)的工艺流程如图:
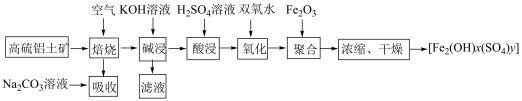
已知:常温下, ,
, 。
。
(1)铁元素位于元素周期表的第______ 周期第______ 族。
(2)①“焙烧”过程会产生 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②用某浓度的 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。
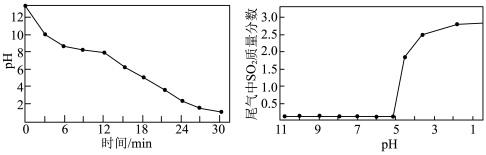
则每隔___________  需要更换
需要更换 溶液。
溶液。
(3)若在实验室“焙烧”,则盛放固体物质的容器名称为___________ ;“碱浸”时应将焙烧渣粉碎后再研磨成细粉,目的是___________ 。
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。
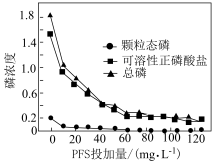
①当PFS投加量小于 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为___________ 。
②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为___________ 。
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。
b.准确量取 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。
c.用 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。
该聚合硫酸铁样品中铁的含量___________ (填“已达到”或“未达到”)一等品质指标要求。

已知:常温下,
(1)铁元素位于元素周期表的第
(2)①“焙烧”过程会产生
②用某浓度的

则每隔
(3)若在实验室“焙烧”,则盛放固体物质的容器名称为
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。

①当PFS投加量小于
②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取
b.准确量取
c.用
该聚合硫酸铁样品中铁的含量
23-24高三上·河北保定·期中
类题推荐
I.Mg(OH)2具有广泛的用途。以菱镁矿(主要成分是MgCO3,含少量Al2O3、FeO等)为原料制备Mg(OH)2的工艺流程如下:
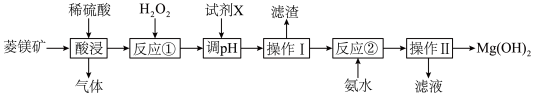
已知:常温下,部分氢氧化物开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“气体”的电子式是___________ 。
(2)下列操作不能显著增大“酸浸”速率的是___________ (填标号)。
a.适当增大稀硫酸的浓度 b.适当升高浸取液的温度 c.增大压强 d.将菱镁矿粉碎
(3)写出反应①的离子方程式:___________ 。
(4)“调pH”时,合适的pH是___________ (填标号)。
a.1.9 b.3.4 c.7.6 d.9.6
常温下,滴加氨水时,Mg2+的浓度为1.0×10-5 mol⋅L-1时被认为完全沉淀,这时的pH为x,x=___________ (已知:常温下, ,
, )。
)。
II.聚合硫酸铁 是一种无机高分子絮凝剂,可用于水的处理。
是一种无机高分子絮凝剂,可用于水的处理。
聚合硫酸铁 产品的组成可通过下列实验测定:
产品的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁样品配成100.00mL溶液A;
②准确量取20.00mL溶液A,加入足量盐酸酸化后,加BaCl2(ag)至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
④准确量取25.00mL溶液B,用0.1000mol⋅L-1的KMnO4(H+)滴定至终点,消耗KMnO4(ag)8.00mL。
(5)该聚合硫酸铁的化学式为___________ 。若步骤③配制溶液B操作时间过长,则y会___________ (选填“偏大”“偏小”或“不变”)。

已知:常温下,部分氢氧化物开始沉淀和完全沉淀的pH如下表所示:
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.8 |
(1)“气体”的电子式是
(2)下列操作不能显著增大“酸浸”速率的是
a.适当增大稀硫酸的浓度 b.适当升高浸取液的温度 c.增大压强 d.将菱镁矿粉碎
(3)写出反应①的离子方程式:
(4)“调pH”时,合适的pH是
a.1.9 b.3.4 c.7.6 d.9.6
常温下,滴加氨水时,Mg2+的浓度为1.0×10-5 mol⋅L-1时被认为完全沉淀,这时的pH为x,x=
II.聚合硫酸铁
聚合硫酸铁
①称取一定质量的聚合硫酸铁样品配成100.00mL溶液A;
②准确量取20.00mL溶液A,加入足量盐酸酸化后,加BaCl2(ag)至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
④准确量取25.00mL溶液B,用0.1000mol⋅L-1的KMnO4(H+)滴定至终点,消耗KMnO4(ag)8.00mL。
(5)该聚合硫酸铁的化学式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网