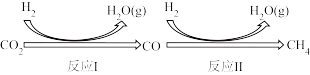多选题 适中0.65 引用1 组卷80
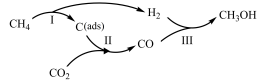
中国承诺2030年前,CO2的排放不再增长,达到峰值之后逐步降低,2060年前实现“碳中和”。其中研发CO2的利用技术,将CO2转化为能源是缓解环境和解决能源问题的方案之一、由CO2和CH4制备合成气(CO、H2),再由合成气制备CH3OH的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法不正确的是

| A.标准状况下,11.2LCH4所含的极性键为2NA |
| B.一定条件下等物质的量的CH3OH和CH4,CH3OH的质子数比CH4多8NA |
| C.反应的化学方程式为CO+2H2 |
| D.制备合成气的反应中,若生成2molCO,反应I和II中共转移电子数为4NA |
23-24高一下·全国·课时练习
类题推荐
当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一。
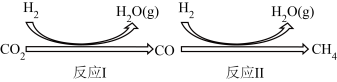
I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
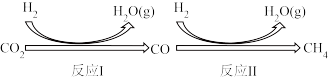
已知:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1=-205kJ·mol-1
CH4(g)+2H2O(g)△H1=-205kJ·mol-1
反应II:CO(g)+3H2(g) CH4(g)+H2O(g)△H2=-246kJ·mol-1
CH4(g)+H2O(g)△H2=-246kJ·mol-1
(1)则反应I的热化学方程式为_______ 。
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=_______ 反应II的平衡常数Kp=_______ (用含字母P的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替,某气体分压=气体总压强×该气体的物质的量分数)
II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H=50kJ/mol。
CH3OH(g)+H2O(g)∆H=50kJ/mol。
(3)能说明反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是_______(填字母)。
CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是_______(填字母)。
III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H<0;
CH3OCH3(g)+3H2O(g)△H<0;
②CO2(g)+H2(g) CO(g)+H2O(g)△H>0。
CO(g)+H2O(g)△H>0。
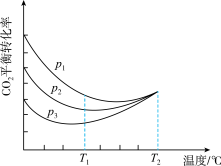
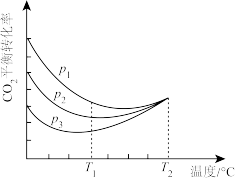
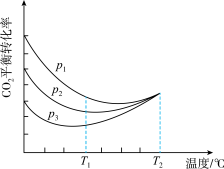
(4)向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为_______ ;T2°C时主要发生反应_______ 。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为_______ 。
I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
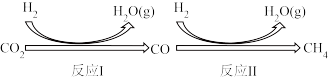
已知:CO2(g)+4H2(g)
反应II:CO(g)+3H2(g)
(1)则反应I的热化学方程式为
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=
II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g)
(3)能说明反应CO2(g)+3H2(g)
| A.单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)
②CO2(g)+H2(g)
(4)向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为

当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一、
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为___________ 。
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
___________ ,CH4的体积分数=___________ 。
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为___________ ;T2℃时主要发生反应________ (填“①”或“②”)。
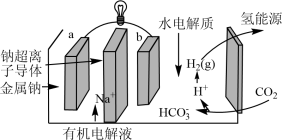
(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为________ 极,b极区的电极反应式为___________ 。
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。

已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
| A.单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为

(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网