解答题-原理综合题 较难0.4 引用1 组卷93
工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
 ,
, 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
。
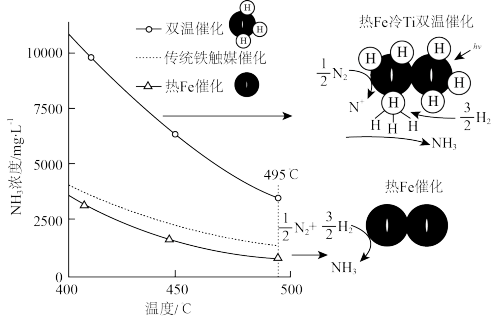
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用 双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:
双催化剂,通过光辐射产生温差(如体系温度为495℃时, Fe的温度为:  而
而  的温度为
的温度为 
(3)下列说法正确的是___________ 。
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二: 复合催化剂。
复合催化剂。
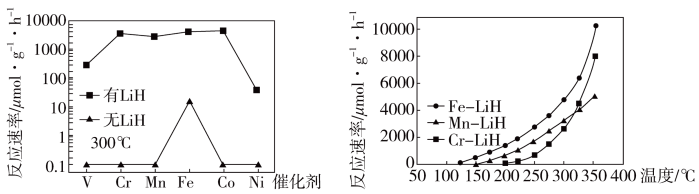
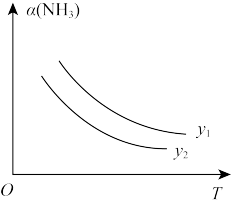
(4)下列说法正确的是___________ 。
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
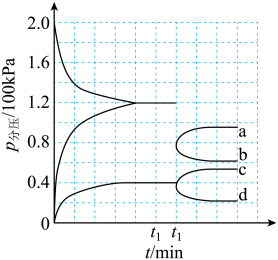
(5)某合成氨速率方程为: 根据表中数据,
根据表中数据,
____________ 。
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
(1)合成氨反应在常温下
(2)
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用

(3)下列说法正确的是
a 氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
a.“热Fe”高于体系温度,有利于提高氨的平衡产率
d. “冷 Ti”低于体系温度,有利于提高合成氨反应速率
方案二:

(4)下列说法正确的是
a. 300℃时,复合催化剂比单一催化剂效率更高
b. 同温同压下,复合催化剂有利于提高氨的平衡产率
c. 温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为:
| 实验 | c(N2)/mol·L-1 | c(H2)/mol·L-1 | c(NH3)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a. 有利于平衡正向移动 b. 防止催化剂中毒 c. 提高正反应速率
23-24高二上·天津和平·期中
类题推荐
工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二: 复合催化剂。
复合催化剂。
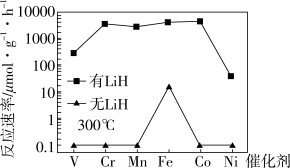
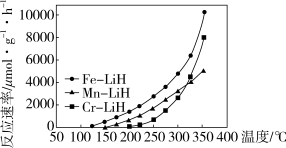
下列说法正确的是___________ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
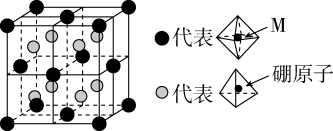
(5)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为 配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 ,则M元素为
,则M元素为___________ (填元素符号);在该化合物中,M离子的价电子排布式为___________ 。
回答下列问题:
(1)合成氨反应在常温下
(2)
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二:


下列说法正确的是
a.
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
| 实验 | ||||
| 1 | m | n | p | q |
| 2 | n | p | ||
| 3 | m | n | ||
| 4 | m | p |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为

氨是最基本的化工原料之一,工业合成氨是人类科学技术的一项重大突破,目前己有三位科学家因其获得诺贝尔奖,其反应原理为:
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用___________ ℃。增大压强,既有利于提高反应速率,又有利于提高平衡转化率。但是,压强越大,对材料的强度和设备的要求就越高,需要的动力也越大,这样会大大增加成本,并可能降低综合经济效益。目前,我国的合成氨厂,一般采用的压强为___________  。
。
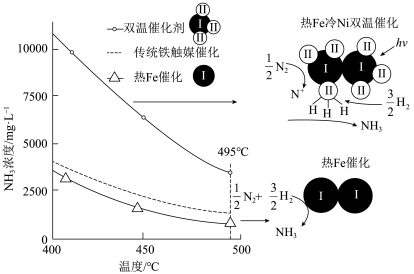
(3)针对反应速率与平衡产率的矛盾,我国科学家在2016年合成了一种新型催化剂( 复合催化剂)较好的解决二者矛盾。
复合催化剂)较好的解决二者矛盾。

下列说法正确的是___________ 。
A. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
A.提高正反应速率 B.防止催化剂中毒 C.有利于平衡正向移动
回答下列问题:
(1)合成氨反应在常温下
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家在2016年合成了一种新型催化剂(

下列说法正确的是
A.
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
| 实验 | ||||
| 1 | m | n | p | q |
| 2 | n | p | ||
| 3 | m | n | ||
| 4 | m | p |
A.提高正反应速率 B.防止催化剂中毒 C.有利于平衡正向移动
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网