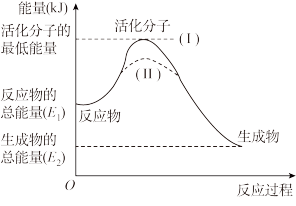
填空题 适中0.65 引用1 组卷34
用 、
、 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1: ;
; 。总反应的化学方程式为:
。总反应的化学方程式为:_______ , 在该反应中的作用
在该反应中的作用_________ 。
(2)资料2: 分解反应过程中能量变化如图所示,其中①有
分解反应过程中能量变化如图所示,其中①有 加入,②无
加入,②无 加入。下列判断正确的是
加入。下列判断正确的是___________ (填字母)。
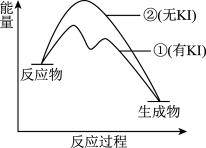
A.加入 后降低了反应所需的活化能
后降低了反应所需的活化能
B.加入 后该反应的活化分子百分数减小
后该反应的活化分子百分数减小
C. 是放热反应
是放热反应
(3)实验中发现, 与
与 溶液混合后,产生大量气泡,溶液颜色变黄。再加入
溶液混合后,产生大量气泡,溶液颜色变黄。再加入 ,振荡、静置,气泡明显减少。
,振荡、静置,气泡明显减少。
资料3: 也可催化
也可催化 的分解反应。
的分解反应。
①加 并振荡、静置后还可观察到
并振荡、静置后还可观察到___________ ,说明有 生成。
生成。
②气泡明显减少的原因可能是:i. 浓度降低;
浓度降低;
ii.___________ 。
③以下对照实验说明ii不是主要原因:向 溶液中加入
溶液中加入 溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入
溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入 ,B试管中不加
,B试管中不加 ,分别振荡、静置。观察到的现象是
,分别振荡、静置。观察到的现象是________ 。
(4)资料4: 。为了探究体系中含碘微粒的存在形式,进行实验:向
。为了探究体系中含碘微粒的存在形式,进行实验:向 一定浓度的
一定浓度的 溶液中加入
溶液中加入 溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:
溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:
则a=___________ ,进而推出该平衡体系中除了含有 、
、 、
、 外,一定还含有其他含碘微粒。
外,一定还含有其他含碘微粒。
(1)资料1:
(2)资料2:

A.加入
B.加入
C.
(3)实验中发现,
资料3:
①加
②气泡明显减少的原因可能是:i.
ii.
③以下对照实验说明ii不是主要原因:向
(4)资料4:
| 微粒 | |||
| 浓度/( | a |
23-24高二上·四川内江·阶段练习
类题推荐
实验小组探究金属银与碘水的反应。
已知25℃时:i.碘水中 、
、
ii.次碘酸不稳定,室温下部分分解为碘酸。
iii. ;AgI在浓KI溶液中可以(无色)形式存在。
;AgI在浓KI溶液中可以(无色)形式存在。
将碘水I2溶于蒸馏水)加入盛有银粉的试管中,实验记录如下:
(1)碘水中I2与H2O反应的化学方程式为___________ 。
(2)针对实验Ⅰ现象a“棕黄色溶液迅速变为无色”的原因,实验小组提出如下假设:
假设1:银粉与氢碘酸发生反应___________ (填化学方程式)生成碘化银,使碘单质减少;。
假设2:银粉与碘单质直接化合生成碘化银,使碘单质减少;
假设3:银粉与氢碘酸及O2共同作用生成碘化银,使碘单质减少。
实验小组结合资料分析并设计实验验证假设:
①结合数据和实验现象判断假设l___________ (填“是”或“不是”)主要原因。
②通过实验证实银粉表面生成了AgI:取表面变暗的银粉,加入一定量浓KI溶液,振荡,静置,取上层清液,加蒸馏水稀释,出现黄色浑浊。用化学平衡移动原理解释出现黄色浑浊的原因:___________ 。
③资料表明假设2成立。
④实验小组针对假设3,在实验Ⅰ的基础上设计了实验Ⅱ和实验Ⅲ:
实验Ⅱ:取一定量碘水,加入CCl4,充分振荡后分液,取上层清液,加入淀粉溶液,未见明显变化;加入稀硫酸后溶液变蓝。
实验Ⅲ:向实验Ⅰ最后所得溶液中加入___________ (填试剂),溶液立即变蓝。
综合实验Ⅰ、实验Ⅱ、实验Ⅲ,可以证实假设3.分析实验Ⅱ的作用是___________ 。
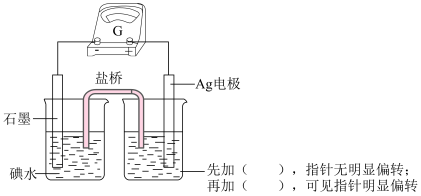
(3)反思:实验小组认为,本实验Ag与碘水反应的过程中,AgI的生成促进了体系中氧化还原反应的进行。进行电化学实验证实。补全下图所示电化学装置中的试剂__________ 、__________ 。
已知25℃时:i.碘水中
ii.次碘酸不稳定,室温下部分分解为碘酸。
iii.
将碘水I2溶于蒸馏水)加入盛有银粉的试管中,实验记录如下:
| 实验Ⅰ | 现象 |
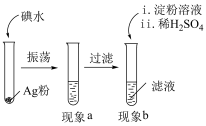 | 现象a:棕黄色溶液(pH≈5.9)迅速变为无色,Ag粉表面略变暗,未见其他明显现象,溶液pH≈6.2。 现象b:滴加淀粉溶液,未见明显变化;继续滴加稀H2SO4,溶液仍未见明显变化。 |
(2)针对实验Ⅰ现象a“棕黄色溶液迅速变为无色”的原因,实验小组提出如下假设:
假设1:银粉与氢碘酸发生反应
假设2:银粉与碘单质直接化合生成碘化银,使碘单质减少;
假设3:银粉与氢碘酸及O2共同作用生成碘化银,使碘单质减少。
实验小组结合资料分析并设计实验验证假设:
①结合数据和实验现象判断假设l
②通过实验证实银粉表面生成了AgI:取表面变暗的银粉,加入一定量浓KI溶液,振荡,静置,取上层清液,加蒸馏水稀释,出现黄色浑浊。用化学平衡移动原理解释出现黄色浑浊的原因:
③资料表明假设2成立。
④实验小组针对假设3,在实验Ⅰ的基础上设计了实验Ⅱ和实验Ⅲ:
实验Ⅱ:取一定量碘水,加入CCl4,充分振荡后分液,取上层清液,加入淀粉溶液,未见明显变化;加入稀硫酸后溶液变蓝。
实验Ⅲ:向实验Ⅰ最后所得溶液中加入
综合实验Ⅰ、实验Ⅱ、实验Ⅲ,可以证实假设3.分析实验Ⅱ的作用是
(3)反思:实验小组认为,本实验Ag与碘水反应的过程中,AgI的生成促进了体系中氧化还原反应的进行。进行电化学实验证实。补全下图所示电化学装置中的试剂

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网