解答题-原理综合题 较难0.4 引用1 组卷263
乙烯产量是衡量一个国家石油化工发展水平的重要标志,羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应:
副反应:
(1) 的燃烧热
的燃烧热 的燃烧热
的燃烧热 ,
, ,则
,则
___________ 。
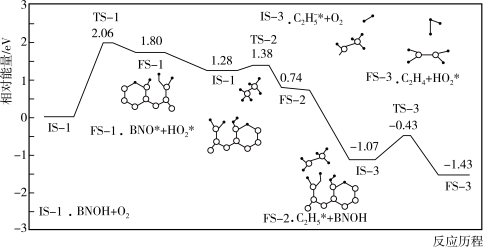
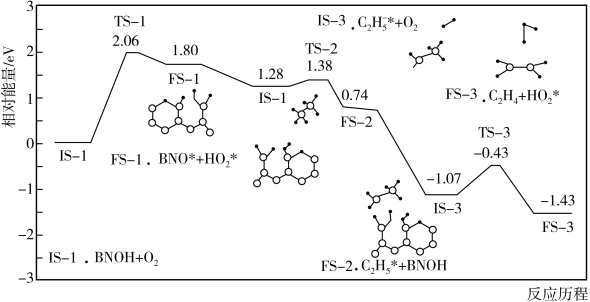
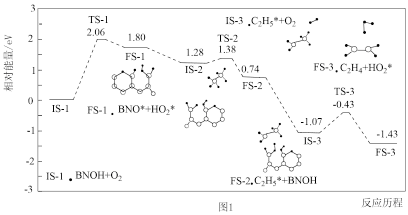
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能
___________  。
。
(3)提高乙烯平衡产率的方法是___________ (任写两条),提高乙烯单位时间产量的关键因素是___________ 。
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
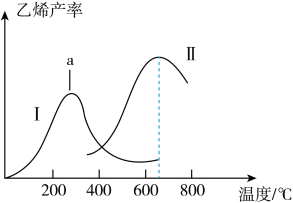
①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是___________ 。
②两种催化剂比较,催化剂Ⅱ的优点与不足是___________ 。
(5)一定温度下,维持压强始终为p,向反应装置中通入 、
、 和
和 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为 ,乙烯选择性为
,乙烯选择性为 ,(乙烯选择性
,(乙烯选择性 )。
)。
①反应速率
___________  。
。
②已知:气体分压 气体总压
气体总压 气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则主反应在该温度下的
,则主反应在该温度下的
___________ (列出计算式即可,不必化简)。
主反应:
副反应:
(1)
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能

(3)提高乙烯平衡产率的方法是
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的

①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是
②两种催化剂比较,催化剂Ⅱ的优点与不足是
(5)一定温度下,维持压强始终为p,向反应装置中通入
①反应速率
②已知:气体分压
23-24高二上·福建厦门·期中
类题推荐
I.回答下列问题:
(1)已知物质A和B在定条件下可以合成物质AB,催化剂K可以高效催化该反应进行。该反应的历程如下:
总:A+B+K=KAB △H<0;
第一步:A+K=AK △H1>0(慢);
第二步:AK+B=AB+K △H2<0(快)。
能正确表示该历程的图象为____ 。
注:----为无催化剂的能量曲线,——为有催化剂的能量曲线
II.乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一。羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应:2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) △H1=-211.6 kJ·mol-1;
2C2H4(g)+2H2O(g) △H1=-211.6 kJ·mol-1;
副反应:C2H4(g)=C2H2(g)+H2(g) △H2=+174.3 kJ·mol-1。
(2)主反应分多步进行,其中的部分反应历程如图1所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能E正=____ 。
(3)能提高乙烯平衡产率的方法是____ ,提高乙烯反应选择性的关键因素是____ 。
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的C2H6、O2和N2混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如图2所示。

①a点____ (填“是”或“不是”)对应温度下乙烯的平衡产率,并说明理由____ 。
②温度较低时乙烯的产率随温度变化不大的主要原因是____ 。
(5)在一定温度下,维持压强为3 MPa,向反应装置中通入1 mol C2H6、1 mol O2和3 mol N2的混合气体,经过一段时间后,反应达到平衡,若此时乙烷的转化率为80%,假设乙烯选择性为100%(乙烯选择性= ×100%),则该温度下反应2C2H6(g)+O2(g)
×100%),则该温度下反应2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g)的平衡常数Kp=
2C2H4(g)+2H2O(g)的平衡常数Kp=____ MPa。(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)已知物质A和B在定条件下可以合成物质AB,催化剂K可以高效催化该反应进行。该反应的历程如下:
总:A+B+K=KAB △H<0;
第一步:A+K=AK △H1>0(慢);
第二步:AK+B=AB+K △H2<0(快)。
能正确表示该历程的图象为
注:----为无催化剂的能量曲线,——为有催化剂的能量曲线
A.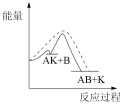 | B.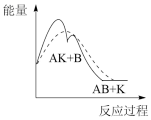 |
C.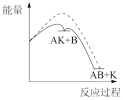 | D.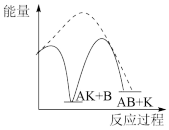 |
II.乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一。羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应:2C2H6(g)+O2(g)
副反应:C2H4(g)=C2H2(g)+H2(g) △H2=+174.3 kJ·mol-1。
(2)主反应分多步进行,其中的部分反应历程如图1所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能E正=

(3)能提高乙烯平衡产率的方法是
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的C2H6、O2和N2混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如图2所示。

①a点
②温度较低时乙烯的产率随温度变化不大的主要原因是
(5)在一定温度下,维持压强为3 MPa,向反应装置中通入1 mol C2H6、1 mol O2和3 mol N2的混合气体,经过一段时间后,反应达到平衡,若此时乙烷的转化率为80%,假设乙烯选择性为100%(乙烯选择性=
乙烷催化脱氢氧化制备乙烯是化工生产中的重要工艺,羟基氮化硼可高效催化乙烷氧化脱氢制乙烯:
主反应:2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) ΔH1<0;
2C2H4(g)+2H2O(g) ΔH1<0;
副反应:C2H4(g) C2H2(g)+H2(g) ΔH2>0。
C2H2(g)+H2(g) ΔH2>0。
回答下列问题:
(1)副反应在一定温度下能自发进行的原因为___________ 。
(2)一定能有利于提高平衡体系中乙烯体积分数的措施有___________(填标号)。
(3)主反应在管式反应器中进行,实际投料往往需要适当增大O2用量,其目的是_________________ 。
(4)主反应分多步进行,其中的部分反应历程如图1所示,该历程的催化剂是___________ ,这一部分反应中决速步骤反应的活化能E正=___________ eV。

(5)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的C2H6、O2和N2混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率曲线I、II如图2所示。

a点___________ ( 填“是”或“不是”)对应温度下乙烯的平衡产率,并说明理由____________ 。
(6)在一定温度下,维持压强为3 MPa,向反应装置中通入1 mol C2H6、1mol O2和3 mol N2的混合气体,该温度下只发生主反应:2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g)。经过一段时间后,反应达到平衡,此时乙烷的转化率为80%,则该反应的平衡常数Kp=
2C2H4(g)+2H2O(g)。经过一段时间后,反应达到平衡,此时乙烷的转化率为80%,则该反应的平衡常数Kp=_______ MPa。(列计算式即可,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
主反应:2C2H6(g)+O2(g)
副反应:C2H4(g)
回答下列问题:
(1)副反应在一定温度下能自发进行的原因为
(2)一定能有利于提高平衡体系中乙烯体积分数的措施有___________(填标号)。
| A.适当升温 | B.适当降温 |
| C.适当加压 | D.分离出H2O |
(4)主反应分多步进行,其中的部分反应历程如图1所示,该历程的催化剂是

(5)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的C2H6、O2和N2混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率曲线I、II如图2所示。

a点
(6)在一定温度下,维持压强为3 MPa,向反应装置中通入1 mol C2H6、1mol O2和3 mol N2的混合气体,该温度下只发生主反应:2C2H6(g)+O2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网