解答题-原理综合题 适中0.65 引用1 组卷75
研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L 溶液的滴定曲线如图所示。
溶液的滴定曲线如图所示。
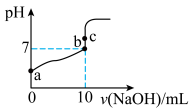
① 在水中的电离方程式为:
在水中的电离方程式为:___________ 。
②下列说法正确的是___________ 。
A.a点溶液的
B.b点溶液中:
C.c点溶液中,
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
①25℃时,浓度均为0.1mol/L的 溶液、NaClO溶液的碱性较大的是
溶液、NaClO溶液的碱性较大的是___________ 。
②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中
___________ mol/L。
③下列化学反应可能发生的是___________ 。
A.
B.
④亚磷酸( )为二元酸,具有较强的还原性
)为二元酸,具有较强的还原性 是
是_______ (填“酸式盐”、“碱式盐”或“正盐”)。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L

①
②下列说法正确的是
A.a点溶液的
B.b点溶液中:
C.c点溶液中,
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
| 化学式 | HClO | |||
| 名称 | 醋酸 | 次氯酸 | 碳酸 | 亚磷酸 |
| 电离平衡常数 |
②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中
③下列化学反应可能发生的是
A.
B.
④亚磷酸(
23-24高二上·海南海口·期中
类题推荐
研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。

①a点溶液的pH_______ 1(填“>”、“<”或“=”,下同)。
②b点溶液中,c(Na+)_______ c(CH3COO-)。
③c点溶液中,c(Na+)_______ [c(CH3COO-)+c(CH3COOH)]。
④比较a、c两点水的电离程度:a_______ c。
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=_______ 。
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)_______ pH(CH3COONa) (填“>”、“<”或“=”)。
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01 mol/L,达到电离平衡时溶液中c(H+)=_______ mol/L。(已知 =4.2)
=4.2)
④下列化学反应能发生的是_______ 。
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。

①a点溶液的pH
②b点溶液中,c(Na+)
③c点溶液中,c(Na+)
④比较a、c两点水的电离程度:a
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数(Ka) | 1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | 4.0×10-8 |
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01 mol/L,达到电离平衡时溶液中c(H+)=
④下列化学反应能发生的是
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LCH3COOH溶液的滴定曲线如下图所示。
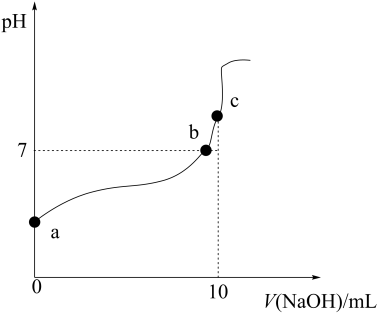
①a点溶液的pH___________ 1(填“>”、“<”或“=”,下同)。
②b点溶液中,c(Na+)___________ c(CH3COO−)。
③c点溶液中,c(Na+)___________ [c(CH3COO−)+c(CH3COOH)]。
④比较a、c两点水的电离程度:a___________ c。
(2)已知:25℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=___________ 。
②25℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)___________ pH(CH3COONa)(填“>”、“<”或“=”)。
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=___________ mol/L。(已知: =4.2)
=4.2)
④下列化学反应能发生的是___________ 。
a.HClO+CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2+H2O+2NaClO=Na2CO3+2HClO
(3)25℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液的pH范围为___________ 。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LCH3COOH溶液的滴定曲线如下图所示。

①a点溶液的pH
②b点溶液中,c(Na+)
③c点溶液中,c(Na+)
④比较a、c两点水的电离程度:a
(2)已知:25℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①CH3COOH的电离平衡常数表达式Ka=
②25℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)
③25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=
④下列化学反应能发生的是
a.HClO+CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2+H2O+2NaClO=Na2CO3+2HClO
(3)25℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液的pH范围为
研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。
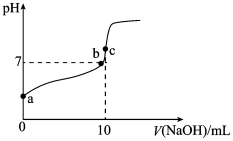
①a点溶液的pH_______ 1(填“>”、“<”或“=”,下同)。
②b点溶液中,c(Na+)_______ c(CH3COO-)。
③c点溶液中,c(Na+)_______ [c(CH3COO-)+c(CH3COOH)]。
④比较a、c两点水的电离程度:a_______ c。
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=_______ 。
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)_______ pH(CH3COONa) (填“>”、“<”或“=”)。
③25℃时,用pH=2硫酸滴定pH=12 NaOH溶液时当二者体积相等混合液pH=_______ 。
④下列化学反应能发生的是_______ 。
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。

①a点溶液的pH
②b点溶液中,c(Na+)
③c点溶液中,c(Na+)
④比较a、c两点水的电离程度:a
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数(Ka) | 1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | 4.0×10-8 |
①CH3COOH的电离平衡常数表达式Ka=
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)
③25℃时,用pH=2硫酸滴定pH=12 NaOH溶液时当二者体积相等混合液pH=
④下列化学反应能发生的是
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


