解答题-原理综合题 适中0.65 引用2 组卷53
合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。_______ (填字母编号)。
A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的
___________ (用p表示,气体分压=总压×物质的量分数)。
(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
而实际流程从合成塔出来的混合气体中含有氨约为15%,这表明_______ 。
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是_______ 。
(4)据统计,每年全世界在合成氨工业中向外排放 高达40亿吨,为循环使用
高达40亿吨,为循环使用 减少浪费,常见的方法是利用合成氨的产品
减少浪费,常见的方法是利用合成氨的产品 和副产品
和副产品 合成尿素:
合成尿素:
①
 kJ/mol
kJ/mol 
②
 kJ/mol
kJ/mol 
副反应:
已知活化能大小: ,某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是
,某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是_______ 。
(5)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因___________。

A.温度、压强对化学平衡的影响
B.催化剂铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(2)工业生产中氮气与氢气按物质的量之比为1∶2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为x mol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的
(3)合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,若进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
| 压强 | 20MPa | 60MPa |
| 500℃ | 19.1 | 42.2 |
A.表中所测数据有明显误差 B.生产条件控制不当
C.氨的分解速率大于预测值 D.合成塔中的反应并未达到平衡
该流程控制含氨约为15%的原因是
(4)据统计,每年全世界在合成氨工业中向外排放
①
②
副反应:
已知活化能大小:
(5)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因___________。
| A.氨易获得,成本较低 |
| B.氨过剩可提高二氧化碳的转化率,加快合成速率 |
| C.氨气可与体系内水结合,减少氨基甲酸铵水解,抑制副反应发生 |
| D.氨结合水,促进(4)中反应②正向移动 |
23-24高二上·山东枣庄·期中
类题推荐
研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
 .回答下列问题。
.回答下列问题。
(1)汽车在行驶过程中有如下反应发生:




写出表示CO燃烧热的热化学方程式为___________ 。
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷( ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为___________ (保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为___________ 。
(3)在汽车上安装三元催化转化器可实现反应:
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
该反应在1~4s内的平均反应速率为
___________ 。反应达平衡时压强为100kPa,求压强平衡常数
___________  。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出): 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
(4)研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。
(5)实际工业生产中,原料气中 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)___________ 。
(6)在氨气催化氧化制硝酸过程中,发现 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
① (快)
(快) 
② (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是___________ 。
(1)汽车在行驶过程中有如下反应发生:
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
(3)在汽车上安装三元催化转化器可实现反应:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 | |
| 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |
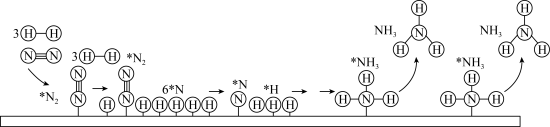
(4)研究表明,合成氨的速率与相关物质的浓度关系为
| A.合成氨的反应在任意温度下都能自发进行 |
| B.增大 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
(6)在氨气催化氧化制硝酸过程中,发现
①
②
根据化学反应原理解释升高温度该反应速率减小的原因可能是
氮的循环在自然界中具有重要的意义。
(1)已知:①

②

③

则合成氨反应的热化学方程式为_______ 。
(2)下列有关合成氨反应的说法正确的是_______ (填字母)。
A.反应温度控制在500℃左右而不是室温能用勒夏特列原理解释
B. 和
和 的物质的量之比保持不变时,说明反应达到平衡状态
的物质的量之比保持不变时,说明反应达到平衡状态
C.该反应的 和
和 都小于零
都小于零
D. 易液化,不断将液氨移去,利于反应正向进行
易液化,不断将液氨移去,利于反应正向进行
E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①
 ;②
;②
 。已知反应①和②的活化能分别为126
。已知反应①和②的活化能分别为126 和13
和13 ,则合成氨反应的
,则合成氨反应的 在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。
在有催化剂(a)和无催化剂(b)时反应过程能量变化图是_______(填字母)。
(4)将一定比例的 和
和 的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时,
的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时, 的转化率随反应温度的变化曲线如图所示。
的转化率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内,随温度升高, 的转化率迅速上升的主要原因是
的转化率迅速上升的主要原因是_______ 。
②当反应温度高于380℃时, 的转化率迅速下降的主要原因可能是
的转化率迅速下降的主要原因可能是_______ 。
(5)在一定温度下,将1 mol 和3 mol
和3 mol  混合置于体积不变的密闭容器中发生工业合成氨反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
混合置于体积不变的密闭容器中发生工业合成氨反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时, 的转化率
的转化率
_______ 。
②已知平衡时,容器压强为8 MPa,则平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为提高 的转化率,实际生产中宜采取的措施有
的转化率,实际生产中宜采取的措施有_______ (填字母)。
A.降低温度 B.最适合催化剂活性的适当高温 C.适当增大压强 D.减小压强 E.循环利用和不断补充氮气 F.及时移出氨
④若达平衡时再将各组分都增加2 mol,此时平衡移动的方向是_______ (填“向正反应方向”、“向逆反应方向”、“不移动”)。
(1)已知:①
②
③
则合成氨反应的热化学方程式为
(2)下列有关合成氨反应的说法正确的是
A.反应温度控制在500℃左右而不是室温能用勒夏特列原理解释
B.
C.该反应的
D.
E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①
A. | B. |
C.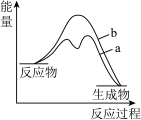 | D. |

①在50℃~150℃范围内,随温度升高,
②当反应温度高于380℃时,
(5)在一定温度下,将1 mol
①达平衡时,
②已知平衡时,容器压强为8 MPa,则平衡常数
③为提高
A.降低温度 B.最适合催化剂活性的适当高温 C.适当增大压强 D.减小压强 E.循环利用和不断补充氮气 F.及时移出氨
④若达平衡时再将各组分都增加2 mol,此时平衡移动的方向是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


