解答题-原理综合题 适中0.65 引用1 组卷52
完成下列问题。
(1)已知:①

②

③

则固态碳和水蒸气反应生成CO和 的热化学方程式为
的热化学方程式为___________ 。
(2)工业上,二氧化碳和氢气在催化剂作用下可以制备甲醇:
CO2(g) + 3H2(g) CH3OH(g) + H2O (g) ΔH
CH3OH(g) + H2O (g) ΔH 0
0
①该反应能在___________ (填“高温”、“低温”或“任何温度”)下自发。
②向2L的恒容密闭容器中充入1molCO2(g),3mol H2(g)欲同时提高CO2的平衡转化率和反应速率,下列措施可能有效的是___________ (填标号)。
a.降低温度并及时分离出产物 b.再向容器中充入1mol H2(g)
c.适当降低温度并加入合适的催化剂
(3)由CO2和H2合成CH3OH 的反应:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH 0,在10L的恒容密闭容器中投入0.5mol CO2和1.75mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示,
0,在10L的恒容密闭容器中投入0.5mol CO2和1.75mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示,
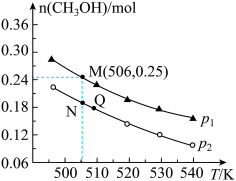
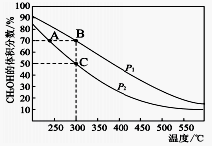
①图中压强p1___________ p2( “>”或“<”)
②M、N、Q三点平衡常数K由大到小顺序为___________ 。
③N点时,该反应的平衡常数K=___________ 。
(1)已知:①
②
③
则固态碳和水蒸气反应生成CO和
(2)工业上,二氧化碳和氢气在催化剂作用下可以制备甲醇:
CO2(g) + 3H2(g)
①该反应能在
②向2L的恒容密闭容器中充入1molCO2(g),3mol H2(g)欲同时提高CO2的平衡转化率和反应速率,下列措施可能有效的是
a.降低温度并及时分离出产物 b.再向容器中充入1mol H2(g)
c.适当降低温度并加入合适的催化剂
(3)由CO2和H2合成CH3OH 的反应:CO2(g)+3H2(g)

①图中压强p1
②M、N、Q三点平衡常数K由大到小顺序为
③N点时,该反应的平衡常数K=
23-24高二上·福建南平·期中
类题推荐
Ⅰ、甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________ 。
②反应Ⅰ中,若△H1﹤0,则要提高甲醇的产率,可采取的措施有_____ (填字母)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1453kJ/mol
②2CO (g)+O2(g)=2CO2(g) △H2=-466kJ/mol
请写出32g甲醇液体发生不完全燃烧生成一氧化碳和液态水的热化学反应方程式:__________ 。
Ⅱ.由CO2和H2合成CH3OH的反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
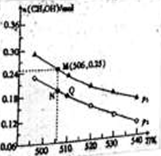
①上述反应的△H_______________ (填“﹥”或“﹤”)0
②图中压强p1___________ (填“﹥”或“﹤”)p2
③经测定知Q点时容器的压强是反应前压强的0.9,若反应从开始到平衡所需的时间为10min,则0~10min内H2的反应速率v(H2)=_____________ 。
④N点时,该反应的平衡常数K=______________ (计算结果保留2位小数)。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
反应Ⅱ:CO2(g)+3H2(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为
②反应Ⅰ中,若△H1﹤0,则要提高甲醇的产率,可采取的措施有
| A.缩小容器的体积 | B.降低温度 | C.升高温度 |
| D.使用合理的催化剂 E.将甲醇从混合体系中分离出来 |
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1453kJ/mol
②2CO (g)+O2(g)=2CO2(g) △H2=-466kJ/mol
请写出32g甲醇液体发生不完全燃烧生成一氧化碳和液态水的热化学反应方程式:
Ⅱ.由CO2和H2合成CH3OH的反应如下:CO2(g)+3H2(g)

①上述反应的△H
②图中压强p1
③经测定知Q点时容器的压强是反应前压强的0.9,若反应从开始到平衡所需的时间为10min,则0~10min内H2的反应速率v(H2)=
④N点时,该反应的平衡常数K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4)=0.5mol/L
CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4)=0.5mol/L