解答题-实验探究题 较难0.4 引用3 组卷243
某化学小组模拟工业生产原理:以废铁屑(含少量 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:
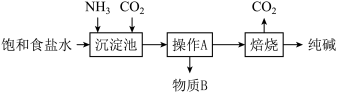
实验流程:
(1)由 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择_________ (填“酒精灯直接加热”或“水浴加热”)。
(2)氧化剂A可以选择 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式___________ 。
(3)下列说法正确的是___________ 。
A.为避免 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水
B.该流程中两次用到 溶液,均可用
溶液,均可用 溶液代替
溶液代替
C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
(4)为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物___________ (填名称)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。
已知: 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。
(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(7)计算铁元素的质量分数___________ 。
已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:
实验流程:
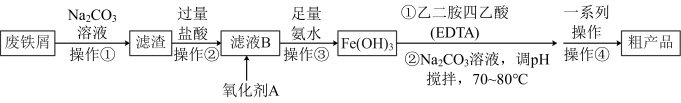
(1)由
(2)氧化剂A可以选择
(3)下列说法正确的是
A.为避免
B.该流程中两次用到
C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、
(4)为使沉淀颗粒增大,实验中往往可以采取
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取
已知:
(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A.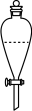 | B. | C.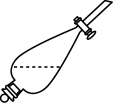 | D. |
(7)计算铁元素的质量分数
23-24高三上·浙江·阶段练习
类题推荐
配合物乙二胺四乙酸铁钠(NaFeY)可溶于水,具有促进膳食中其他铁源或内源性铁源吸收的作用,同时还可促进锌的吸收,是常见的铁营养强化剂。模拟工业生产原理制取乙二胺四乙酸铁钠并测定所制取样品的纯度。
I.产品的制备:
步骤1:准确称取mgFeCl3·6H2O于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应:2Fe(OH)3+Na2CO3+2H4Y=2NaFeY·3H2O+CO2↑+H2O。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
(1)利用FeCl3和氨水的反应制备Fe(OH)3,写出反应的离子方程式___________ 。检验Fe(OH)3洗涤干净的方法是___________ 。
(2)实验中需要控温在80℃反应1小时,最佳的加热方式是___________ 。
(3)方案的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取20.00g样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成250mL溶液,取出25mL加入过量的30.00mL0.1600mol/LEDTA标准溶液并加热煮沸,充分反应后,再用0.2000mol/L的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为5.00mL。
已知:Fe3+、Zn2+与EDTA反应的化学计量比均为1:1。
(4)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(5)计算铁元素的质量分数___________ 。
Ⅲ.某同学为探究富含亚铁盐且保存时间较长的糕点情况,设计了如下实验方案:___________ 。
(7)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)。
(8)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:___________ 。
②【设计方案】
为了对假设2进行验证,简述你的设计方案:___________ 。
I.产品的制备:
步骤1:准确称取mgFeCl3·6H2O于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应:2Fe(OH)3+Na2CO3+2H4Y=2NaFeY·3H2O+CO2↑+H2O。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
(1)利用FeCl3和氨水的反应制备Fe(OH)3,写出反应的离子方程式
(2)实验中需要控温在80℃反应1小时,最佳的加热方式是
(3)方案的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。为使沉淀颗粒增大,实验中往往可以采取
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取20.00g样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成250mL溶液,取出25mL加入过量的30.00mL0.1600mol/LEDTA标准溶液并加热煮沸,充分反应后,再用0.2000mol/L的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为5.00mL。
已知:Fe3+、Zn2+与EDTA反应的化学计量比均为1:1。
(4)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A. | B. | C. | D. |
Ⅲ.某同学为探究富含亚铁盐且保存时间较长的糕点情况,设计了如下实验方案:

(7)加入新制氯水后,溶液红色加深的原因是
(8)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:
②【设计方案】
为了对假设2进行验证,简述你的设计方案:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网