解答题-工业流程题 较难0.4 引用1 组卷140
通过对阳极泥的综合处理可以回收贵重金属,一种从铜阳极泥(主要成分为Se、Ag、Ag2Se、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
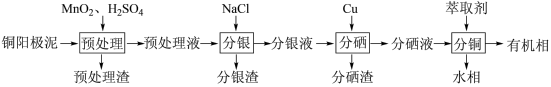
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为_______ 。
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是_______ 。
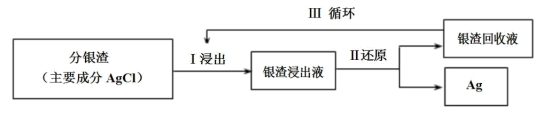
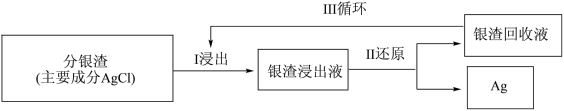
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:_______ 。
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++ ,
,
 H++
H++ ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K( )=
)=_______ (写出含x的计算式)。
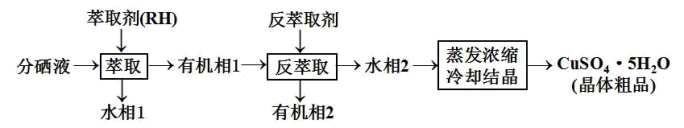
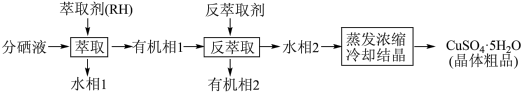
(5)分铜得到产品CuSO4·5H2O的具体操作如图:
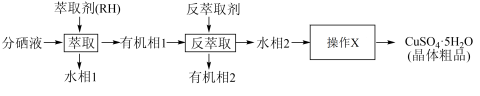
①萃取的原理为:2RH+Cu2+ R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用_______ (填化学式)溶液。
②操作X为_______ ,过滤;
③为了减少CuSO4·5H2O的损失,最好选用_______ 进行洗涤。
A.冷水 B.热水 C.无水乙醇
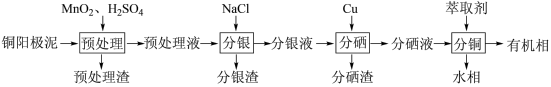
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++
(5)分铜得到产品CuSO4·5H2O的具体操作如图:

①萃取的原理为:2RH+Cu2+
②操作X为
③为了减少CuSO4·5H2O的损失,最好选用
A.冷水 B.热水 C.无水乙醇
23-24高三上·黑龙江哈尔滨·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 Ag(S2O3)
Ag(S2O3)
 R2Cu+2H+,反萃取剂最好选用
R2Cu+2H+,反萃取剂最好选用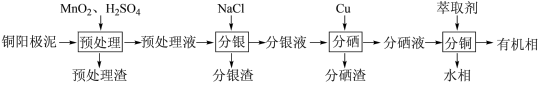
 R2Cu+2H+,反萃取剂最好选用
R2Cu+2H+,反萃取剂最好选用

