解答题-实验探究题 适中0.65 引用1 组卷134
某化学兴趣小组分组通过实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
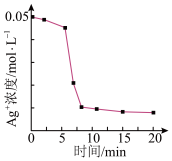
(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。
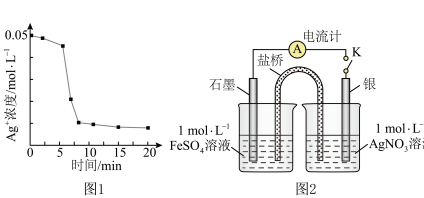
几分钟后迅速出现灰黑色沉淀的可能原因是_____________________ 。20min后取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_____ 。
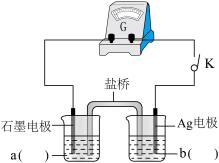
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象__________________ 。指针归零后再向左侧烧杯中加入较浓的Fe2(SO4)3溶液,指针变化为__________ ,综合实验Ⅰ和实验Ⅱ,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在________ (填离子符号) ;随静置时间延长,产生白色沉淀的量越来越少,溶液红色先变深后变浅,请结合离子方程式解释实验现象产生的原因___________________ (反应过程中忽略NO;和空气中氧气的氧化作用;查资料知Ag+与SCN-生成白色沉淀AgSCN)。
(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。

几分钟后迅速出现灰黑色沉淀的可能原因是
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象
(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在
23-24高二上·山东菏泽·期中
类题推荐
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______ (填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________ 。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______ 现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________ 溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
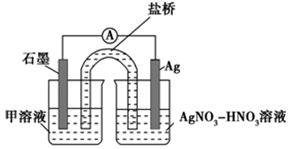
实验Ⅱ:装置如图。其中甲溶液是________ ,操作及现象是________________ 。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的
实验Ⅱ:装置如图。其中甲溶液是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网