解答题-实验探究题 较难0.4 引用1 组卷165
工业中测定铁矿石中铁的含量,目前以氯化亚锡—三氯化钛还原三价铁,再用重铬酸钾滴定法为主。
已知:
回答下列问题:
(1)由 配制氯化亚锡(SnCl2)溶液时,需加入
配制氯化亚锡(SnCl2)溶液时,需加入_____ 。
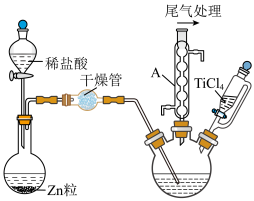
(2)在1000℃下,利用氢气还原四氯化钛(TiCl4)制备三氯化钛(TiCl3)的装置如图所示。
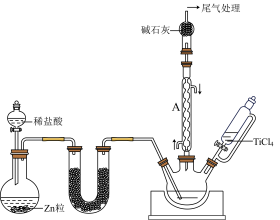
①U形管中可填充的药品为_____ (填字母)。
a.浓硫酸 b.碱石灰 c. d.五氧化二磷
d.五氧化二磷
仪器A的名称是_____ ,利用本实验中制备氢气的装置,还可以制备硫化氢、氨气、二氧化碳、二氧化硫气体中的_____ 种气体(填字母)。
A.1 B.2 C.3 D.4
②三颈瓶应选用石英材质,不能用普通玻璃材质的原因为_____ 。
③安装好实验装置进行实验,实验步骤如下:检查装置的气密性后,加入药品;打开分液漏斗的活塞,_____ (按正确的顺序填入下列步骤的字母)。
a.打开恒压滴液漏斗,加入TiCl4,加热至1000℃,反应一段时间
b.收集气体,检验纯度
c.关闭分液漏斗的活塞
d.停止加热,冷却
(3)铁矿石铁含量的测定,步骤如下:
Ⅰ、取0.4000g铁矿石样品,加入5mL盐酸,趁热滴加氯化亚锡至溶液变为浅黄色。
Ⅱ、向上述溶液中滴加4滴Na2WO4溶液,然后滴加TiCl3溶液充分还原 ,当
,当 还原完全时,
还原完全时, 过量与
过量与 生成蓝色
生成蓝色 ,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的
,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的 。
。
Ⅲ、向溶液中加入适量浓硫酸、浓磷酸和硫酸锰溶液(硫酸锰溶液的作用是消除 的影响),加入指示剂二苯胺磺酸铵,用
的影响),加入指示剂二苯胺磺酸铵,用 K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知:
K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知: 被还原为
被还原为 )。
)。
①计算样品中铁元素的质量分数为_____ %。
②下列操作将导致样品中含铁量的测定值偏高的是_____ (填字母)。
a.步骤Ⅰ中样品溶解不充分
b.步骤Ⅱ中未加入稀K2Cr2O7溶液
c.步骤Ⅲ中未加入MnSO4溶液
d.步骤Ⅲ中读数时,滴定前平视,滴定后俯视
已知:
| 颜色 | 熔点/℃ | 沸点/℃ | 化学性质 | |
| TiCl3 | 紫色 | 440 | 660 | 遇水强烈水解,强还原性 |
| TiCl4 | 无色 | -25 | 136 | 遇水强烈水解 |
| SnCl2 | 白色 | 37.7 | 623 | 易水解,强还原性 |
(1)由
(2)在1000℃下,利用氢气还原四氯化钛(TiCl4)制备三氯化钛(TiCl3)的装置如图所示。

①U形管中可填充的药品为
a.浓硫酸 b.碱石灰 c.
仪器A的名称是
A.1 B.2 C.3 D.4
②三颈瓶应选用石英材质,不能用普通玻璃材质的原因为
③安装好实验装置进行实验,实验步骤如下:检查装置的气密性后,加入药品;打开分液漏斗的活塞,
a.打开恒压滴液漏斗,加入TiCl4,加热至1000℃,反应一段时间
b.收集气体,检验纯度
c.关闭分液漏斗的活塞
d.停止加热,冷却
(3)铁矿石铁含量的测定,步骤如下:
Ⅰ、取0.4000g铁矿石样品,加入5mL盐酸,趁热滴加氯化亚锡至溶液变为浅黄色。
Ⅱ、向上述溶液中滴加4滴Na2WO4溶液,然后滴加TiCl3溶液充分还原
Ⅲ、向溶液中加入适量浓硫酸、浓磷酸和硫酸锰溶液(硫酸锰溶液的作用是消除
①计算样品中铁元素的质量分数为
②下列操作将导致样品中含铁量的测定值偏高的是
a.步骤Ⅰ中样品溶解不充分
b.步骤Ⅱ中未加入稀K2Cr2O7溶液
c.步骤Ⅲ中未加入MnSO4溶液
d.步骤Ⅲ中读数时,滴定前平视,滴定后俯视
23-24高三上·河北沧州·期中
类题推荐
工业中测定铁矿石中铁的含量,目前以氯化亚锡SnCl2—三氯化钛(TiCl3)还原三价铁,再用重铬酸钾滴定法为主。已知:
回答下列问题:
(1)配制 2溶液时,常加入少量的浓盐酸,其作用是
2溶液时,常加入少量的浓盐酸,其作用是_______ 。
(2)在1000℃下,利用氢气还原 4制备
4制备 3的装置如图所示。
3的装置如图所示。
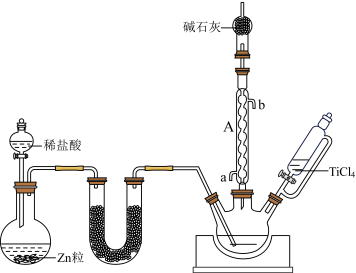
①仪器A的名称是_______ ;冷凝水应从上图仪器A中的_______ 口流出(填“a”或“b”)。
②安装好实验装置,检查装置的气密性后,加入药品,按以下步骤进行实验:
I.打开分液漏斗的活塞,一段时间后收集气体,检验气体纯度;
Ⅱ.打开恒压滴液漏斗,加入 4加热至
4加热至 ℃,反应一段时间,三颈瓶中发生的反应为
℃,反应一段时间,三颈瓶中发生的反应为_______ ;
Ⅲ.停止加热,冷却;
Ⅳ.关闭分液漏斗的活塞。
③图中装有碱石灰的干燥管的作用有_______ 。
(3)将某铁矿石粉碎,取mg铁矿石粉(铁元素的化合价为+2价和+3价)于烧杯中,加入浓盐酸,加热使其充分溶解。冷却后过滤,向滤液中加入 -1盐酸,加热至接近沸腾,然后缓慢滴加一定浓度的
-1盐酸,加热至接近沸腾,然后缓慢滴加一定浓度的 2溶液,至恰好完全反应,停止滴加
2溶液,至恰好完全反应,停止滴加 2溶液。已知:
2溶液。已知: 2的氧化产物为
2的氧化产物为 杂质不参加反应。则
杂质不参加反应。则 2+还原
2+还原 3+的离子方程式是
3+的离子方程式是_______ 。
| 物质 | 颜色 | 熔点/℃ | 沸点/℃ | 化学性质 |
| TiCl3 | 紫色 | 440 | 660 | 遇水强烈水解,强还原性 |
| TiCl4 | 无色 | -25 | 136 | 遇水强烈水解 |
| SnCl2 | 白色 | 37.7 | 623 | 易水解,强还原性 |
(1)配制
(2)在1000℃下,利用氢气还原

①仪器A的名称是
②安装好实验装置,检查装置的气密性后,加入药品,按以下步骤进行实验:
I.打开分液漏斗的活塞,一段时间后收集气体,检验气体纯度;
Ⅱ.打开恒压滴液漏斗,加入
Ⅲ.停止加热,冷却;
Ⅳ.关闭分液漏斗的活塞。
③图中装有碱石灰的干燥管的作用有
(3)将某铁矿石粉碎,取mg铁矿石粉(铁元素的化合价为+2价和+3价)于烧杯中,加入浓盐酸,加热使其充分溶解。冷却后过滤,向滤液中加入
钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备TiCl4(夹持装置略去)。
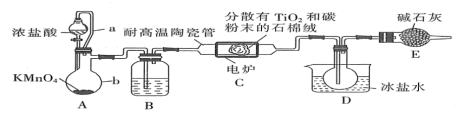
已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其他相关信息如下表所示:
请回答下列问题:
(1)装置A中仪器b的名称_______ ,装置B中所盛试剂为 _______ (写名称) ,装置A中发生反应的离子方程式为 _______ 。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:_______ 。 (填标号)
(3)装置C中石棉绒载体的作用为_______ ,装置D中使用冷水浴收集到粗产品,可采用 _______ 方法提纯。
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2·yH2O,测定产物xTiO2·yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol/L的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。
①写出步骤二中Ti3+被氧化为TiO2+的离子方程式:_______ 。
②通过分析、计算,该样品中的组成为_______ 。

已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中仪器b的名称
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:
(3)装置C中石棉绒载体的作用为
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2·yH2O,测定产物xTiO2·yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol/L的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。
①写出步骤二中Ti3+被氧化为TiO2+的离子方程式:
②通过分析、计算,该样品中的组成为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网