解答题-工业流程题 较难0.4 引用1 组卷82
硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂。以氯化铈(CeCl3)为主要原料合成硫酸铈铵的微型流程如下:
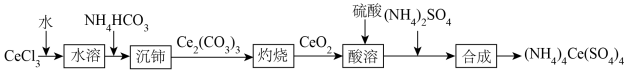
回答下列问题:
(1)基态Ce原子价层电子排布式为4f15d16s2,它有
(2)(NH4)2SO4中阴离子的空间结构是
(3)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,H2CO3的电离常数:Ka1=4.5×10-7、Ka2=4.7×10-12.NH4HCO3溶液显
(4)写出“沉铈”的离子方程式为
(5)“灼烧”发生反应为2Ce2(CO3)(s)+O2(g)
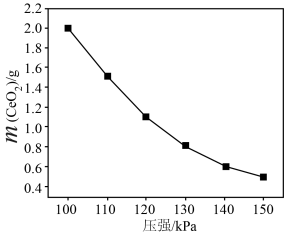
随着压强增大,CeO2质量逐渐
(6)CeO2的立方晶胞如图所示。NA为阿伏加德罗常数的值,两个铈离子最近距离为a nm。
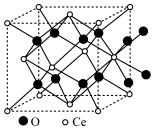
①该晶胞中,氧离子与
a.正四边形 b.正八面体 c.正四面体 d.三角锥形
②晶体密度为
23-24高三上·江西宜春·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
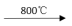 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是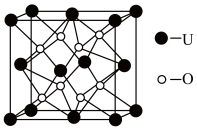

 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑ 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑ 。则左边氮原子和中间氮原子的杂化方式分别为
。则左边氮原子和中间氮原子的杂化方式分别为


