解答题-实验探究题 适中0.65 引用2 组卷118
工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量(通常以
含量(通常以 废水中的微粒质量计量)的方法如下:
废水中的微粒质量计量)的方法如下:
步骤I:量取 废水于锥形瓶中,加入适量稀酸酸化。
废水于锥形瓶中,加入适量稀酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取 溶液进行滴定(
溶液进行滴定( ),数据记录如表:
),数据记录如表:
(1)取 固体配制
固体配制 溶液,需要的定量仪器有托盘天平、量筒和
溶液,需要的定量仪器有托盘天平、量筒和___________ 。
(2)步骤I量取 废水选择的仪器是①
废水选择的仪器是①_______ 。
②排除碱式滴定管中气泡的方法应采用如图所示操作中的_______ ,然后小心操作使尖嘴部分充满碱液。
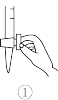


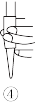
③步骤I中加入适量的酸酸化,该酸可以是_______ (填标号)。
A.盐酸 B.稀硫酸 C.草酸 D.浓硝酸
(3)步骤III中滴加的指示剂为_______ ;滴定达到终点时的实验现象是___________ 。
(4)步骤III中a的读数如图所示,则:
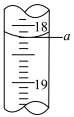
①a=___________ mL。
②计算废水中 含量为
含量为___________ g/L。
(5)以下操作会造成废水中 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
(6)若用25mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___________ (填序号)。
(7)
(8)①=10mL ②=15mL ③<10mL ④>15mL
步骤I:量取
步骤II:加入过量的碘化钾溶液充分反应:
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取
| 滴定次数 | ||
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(1)取
(2)步骤I量取
②排除碱式滴定管中气泡的方法应采用如图所示操作中的
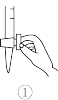


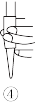
③步骤I中加入适量的酸酸化,该酸可以是
A.盐酸 B.稀硫酸 C.草酸 D.浓硝酸
(3)步骤III中滴加的指示剂为
(4)步骤III中a的读数如图所示,则:

①a=
②计算废水中
(5)以下操作会造成废水中
| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取 |
(6)若用25mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积
(7)
(8)①=10mL ②=15mL ③<10mL ④>15mL
23-24高二上·辽宁沈阳·阶段练习
类题推荐
酸碱中和滴定和氧化还原滴定是重要的定量分析方法。
I.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是___________ (填序号)。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a___________ (填“>”“<”或“=”)20.02。

II.工业废水中常含有一定量氧化性较强的Cr2O ,利用滴定原理测定Cr2O
,利用滴定原理测定Cr2O 含量的方法如下:
含量的方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:Cr2O +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
(3)步骤I量取30.00mL废水选择的仪器是___________ 。
(4)步骤III中滴加的指示剂为___________ ;滴定达到终点时的实验现象是,滴入最后半滴Na2S2O3;溶液,溶液刚好从蓝色变为无色,且30s内不变色。
(5)步骤III中a的读数如图所示,则:
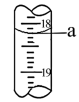
①a=___________ 。
②Cr2O 的含量为
的含量为___________ g·L-1。
(6)以下操作会造成废水中Cr2O 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
I.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(HCl)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a

II.工业废水中常含有一定量氧化性较强的Cr2O
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:Cr2O
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(4)步骤III中滴加的指示剂为
(5)步骤III中a的读数如图所示,则:

①a=
②Cr2O
(6)以下操作会造成废水中Cr2O
| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗 |
工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量的方法如下:
含量的方法如下:
步骤I:量取 废水于锥形瓶中,加入适量稀硫酸酸化。
废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应: 。
。
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取 溶液进行滴定,数据记录如表:(
溶液进行滴定,数据记录如表:( )
)
(1)步骤I量取 废水选择的仪器是
废水选择的仪器是_______ 。
(2)步骤III中滴加的指示剂为_______ ;滴定达到终点时的实验现象是_______ 。

(3)步骤III中a的读数如图所示,则:
①
_______ 。
②原工业废水中 的含量为
的含量为_______  。
。
(4)以下操作会造成废水中 含量测定值偏低的是
含量测定值偏低的是_______ (填字母)。
A.量取 溶液的滴定管用蒸馏水清洗后未用标准液润洗
溶液的滴定管用蒸馏水清洗后未用标准液润洗
B.盛装待测液的锥形瓶用水洗后再用待测液润洗
C.滴定过程中摇动锥形瓶时有少量待测液溅出
D.滴定终点读数时,俯视滴定管的刻度
E.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
步骤I:量取
步骤II:加入过量的碘化钾溶液充分反应:
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取
| 滴定次数 | ||
| 第一次 | 1.02 | 19.02 |
| 第二次 | 1.99 | 16.99 |
| 第三次 | 0.20 | a |
(2)步骤III中滴加的指示剂为

(3)步骤III中a的读数如图所示,则:
①
②原工业废水中
(4)以下操作会造成废水中
A.量取
B.盛装待测液的锥形瓶用水洗后再用待测液润洗
C.滴定过程中摇动锥形瓶时有少量待测液溅出
D.滴定终点读数时,俯视滴定管的刻度
E.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
酸碱中和滴定和氧化还原滴定是重要的定量分析方法。
I.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是___________ (填序号)。
Ⅱ.工业废水中常含有一定量氧化性较强的Cr2O ,利用滴定原理测定Cr2O
,利用滴定原理测定Cr2O 含量的方法如下:
含量的方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
(2)步骤Ⅰ量取30.00mL废水选择的仪器是___________ 。
(3)步骤Ⅲ中滴加的指示剂为___________ ;滴定达到终点时的实验现象是,滴入最后半滴Na2S2O3溶液,溶液刚好从蓝色变为无色,且30s内不变色。
(4)步骤Ⅲ中a的读数如图所示,则:
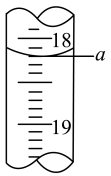
①a=___________ 。
②Cr2O 的含量为
的含量为___________ g·L-1。
(5)以下操作会造成废水中Cr2O 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
I.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
Ⅱ.工业废水中常含有一定量氧化性较强的Cr2O
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(2)步骤Ⅰ量取30.00mL废水选择的仪器是
(3)步骤Ⅲ中滴加的指示剂为
(4)步骤Ⅲ中a的读数如图所示,则:

①a=
②Cr2O
(5)以下操作会造成废水中Cr2O
| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


