解答题-原理综合题 适中0.65 引用1 组卷178
下表是几种弱电解质的电离平衡常数(25℃)
回答下列问题:
(1)由上表分析,若①CH3COOH② ③HA④
③HA④ 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为___________ (填序号)。
(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:___________ ;试写出HA与Na3PO4反应的离子方程式:_______ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
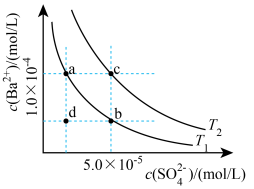
①T1_______ T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是_______ 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
| 电解质 | 电离方程式 | 平衡常数K |
(1)由上表分析,若①CH3COOH②
(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:
(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
| A.若混合液pH>7,则V≥10 |
| B.若混合液pH<7,则 |
| C.V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 |
| D.V=5时, |
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
23-24高二上·上海·期中
类题推荐
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________ (填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____ c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________ (填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________ 。
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
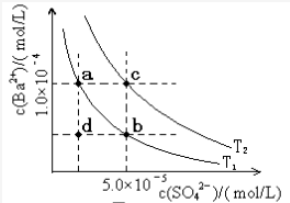
①T1______ T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________ ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______ (填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____ 次。[提示:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
| 电解质 | 电离方程式 | 电离常数K或Ksp |
| CH3COOH | CH3COO CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 |
| H3PO4 | H3PO4  H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 |
| BaSO4 | BaSO4(s) Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq) | 1.07×10-10 |
| BaCO3 | BaCO3(s) Ba2+(aq)+CO2-(aq) Ba2+(aq)+CO2-(aq) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为
(2)写出C6H5OH与Na3PO4反应的离子方程式
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理
 BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)] I.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
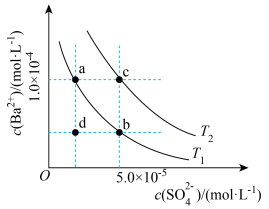
(1)T2________ T1(填“>”“<”或“=”)。
(2)T2温度下BaSO4的Ksp=________ 。
(3)T1温度下d点是BaSO4的________ (填“不饱和”或“过饱和”)溶液。若在a点加入Na2SO4固体可使图像由a点变到________ 点(填“b”或“c”)。
II.回答下列问题:
(4)常温下,pH=9的CH3COONa溶液中,水电离出来的c(OH-)=_______ mol/L。
(5)已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
①写出碳酸的第一步电离方程式_______ 。
②10mLpH=2的盐酸与醋酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_______ 后者(填“>”、“<”或“=”)。
③25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,pH由大到小的顺序为_______ (填序号)。
④25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______ 。

(1)T2
(2)T2温度下BaSO4的Ksp=
(3)T1温度下d点是BaSO4的
II.回答下列问题:
(4)常温下,pH=9的CH3COONa溶液中,水电离出来的c(OH-)=
(5)已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
| 醋酸 | 碳酸 | 氢氰酸 |
| Ka=1.7×10-5 | Ka1=4.5×10-7、Ka2=4.7×10-11 | Ka=6.2×10-10 |
②10mLpH=2的盐酸与醋酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
③25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,pH由大到小的顺序为
④25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
图像分析是研究化学问题的重要手段。请分析以下图像,回答有关问题。
(1)理论分析在密闭容器中发生的反应:N2(g)+3H2(g) 2NH3(g) △H<0。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
2NH3(g) △H<0。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
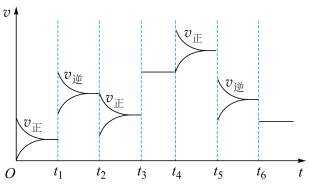
请在以下表格中填入各时刻改变的条件。
(2)密闭容器中,发生反应:mA(g)+nB(g) pC(g)+qD(g) △H。图为C的体积分数φ(C)在不同压强P下随时间t变化的曲线和A的转化率α(A)在不同压强下随温度T变化的曲线。
pC(g)+qD(g) △H。图为C的体积分数φ(C)在不同压强P下随时间t变化的曲线和A的转化率α(A)在不同压强下随温度T变化的曲线。
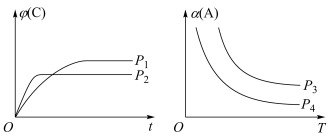
请回答下列问题(填“>”、“=”或“<”):
①m+n________ p+q,②△H________ 0,③P3________ P4。
(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。
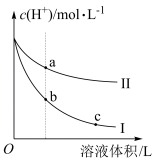
①曲线Ⅱ表示的是______ 稀释的变化曲线。
②将a点溶液与b点溶液混合,醋酸的电离平衡CH3COOH CH3COO-+H+将向
CH3COO-+H+将向________ 移动。
③a、b、c三点的导电能力大小顺序为________ 。
(4)T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
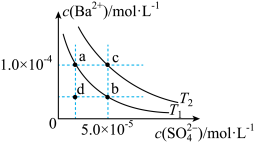
①T1_________ T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=________ 。
②根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________ (填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(1)理论分析在密闭容器中发生的反应:N2(g)+3H2(g)

请在以下表格中填入各时刻改变的条件。
| 时刻 | t1 | t2 | t3 | t4 | t5 | t6 |
| 条件变化 | 使用催化剂 | 增加反应物 |

请回答下列问题(填“>”、“=”或“<”):
①m+n
(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。

①曲线Ⅱ表示的是
②将a点溶液与b点溶液混合,醋酸的电离平衡CH3COOH
③a、b、c三点的导电能力大小顺序为
(4)T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

①T1
②根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


