解答题-原理综合题 适中0.65 引用2 组卷188
氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

回答下列问题:
(1)反应Ⅱ能自发进行的条件是___________ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比[ ]充入
]充入 和
和 ,tmin后反应达到平衡。达到平衡时,容器中CO为mmol,
,tmin后反应达到平衡。达到平衡时,容器中CO为mmol, 为nmol。
为nmol。
①下列说法不正确 的是___________ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比[ ],有利于提高
],有利于提高 的产率
的产率
C.升高温度有利于反应Ⅰ、Ⅱ的平衡正向移动,温度越高越好
D.以 作催化剂,降低反应活化能,提高反应速率和原料利用率
作催化剂,降低反应活化能,提高反应速率和原料利用率
②反应Ⅲ的平衡常数
___________ (用含a,m,n的代数式表示)。
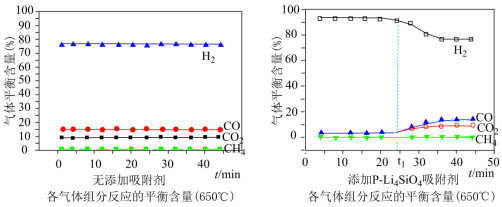
(3)650℃(局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[ ]一定时,催化剂中无添加吸附剂和添加
]一定时,催化剂中无添加吸附剂和添加 吸附剂(吸收
吸附剂(吸收 ),各气体组分反应的平衡含量与时间的关系如图所示:
),各气体组分反应的平衡含量与时间的关系如图所示:
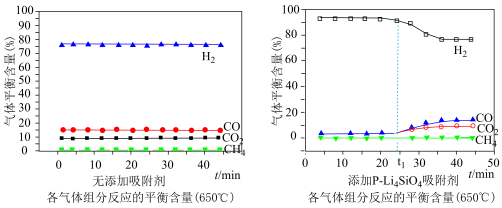
①催化剂中添加 吸附剂与无添加吸附剂比较,
吸附剂与无添加吸附剂比较, 前
前 的平衡含量升高,
的平衡含量升高, 、CO和
、CO和 的平衡含量降低;
的平衡含量降低; 后
后 的平衡含量降低,
的平衡含量降低, 、CO和
、CO和 的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是
的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是___________ 。
②实验时发现 后
后 的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是___________ 。(用化学反应方程式表示)
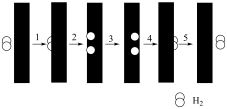
(4)该反应常采用钯膜分离技术(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: ,其活化能
,其活化能 ;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法
;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法不正确 的是___________。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比[
①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比[
C.升高温度有利于反应Ⅰ、Ⅱ的平衡正向移动,温度越高越好
D.以
②反应Ⅲ的平衡常数
(3)650℃(局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[

①催化剂中添加
②实验时发现
(4)该反应常采用钯膜分离技术(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:

| A.钯膜对 |
| B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
| D.常用 |
23-24高三上·浙江·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网