解答题-原理综合题 适中0.65 引用1 组卷19
我国是世界上最大的PO (环氧丙烷,C3H6O)生产国,环氧丙烷是一种高价值化工中间体,广泛用于化工、农药汽车、纺织等行业。回答下列问题:
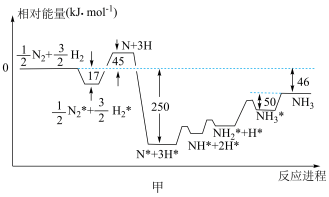
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2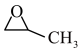 (g),该反应的△H=
(g),该反应的△H=_______ 。【已知:丙烯、环氧丙烷(C3H6O)的燃烧热(△H)分别为-2049 kJ/mol、-1887.6 kJ/mol。]
(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性= ×100%
×100%
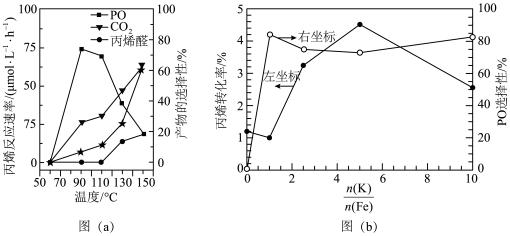
若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是_______ 。
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)
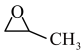 (g)+N2(g)。
(g)+N2(g)。
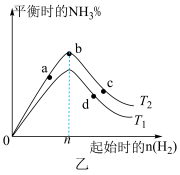
①已知在325℃时,该催化剂中的钾铁比 对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率
对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率_______ (填“是”或“不是”)对应温度下的平衡转化率,判断理由是_______ 。
②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=_______ kPa(用含a的代数式表示,下同),以上反应用平衡分压代替平衡浓度表示的平衡常数Kp=_______ (列出计算式,分压=总压×物质的量分数)。
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2
 (g),该反应的△H=
(g),该反应的△H=(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性=

若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)
 (g)+N2(g)。
(g)+N2(g)。①已知在325℃时,该催化剂中的钾铁比
②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=
23-24高二上·山西太原·期中
类题推荐
许多有氯气参与的工业生产中,消耗氯气的同时,通常会产生大量的副产物氯化氢。工业上可采用氯化氢催化氧化法制取氯气,实现氯资源循环利用,既可提高经济效益,又能减少HCl污染问题。有关反应原理为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=-116kJ·mol-1,该过程具有能耗低、操作简单等优点,目前是最容易实现工业化的方法。回答下列问题:
2Cl2(g)+2H2O(g) △H=-116kJ·mol-1,该过程具有能耗低、操作简单等优点,目前是最容易实现工业化的方法。回答下列问题:
(1)Deacon过程是最早也是最具有代表性的催化氧化法,由Deacon在1875年首先提出。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) △H1=+83kJ·mol-1
Cl2(g) △H1=+83kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) △H2=-20kJ·mol-1
Cl2(g) △H2=-20kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3
其中,△H3=____ kJ·mol-1。
(2)关于氯化氢催化氧化法制氯气的反应,下列说法正确的是____ (填字母)。
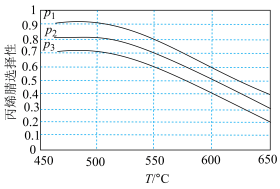
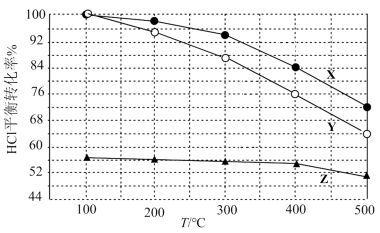
(3)如图为容积一定的容器中,不同进料浓度比( )时HCl平衡转化率随温度变化的关系,其中进料浓度比最大的是
)时HCl平衡转化率随温度变化的关系,其中进料浓度比最大的是____ 曲线(用“X、Y或Z”表示)。在温度一定、进料浓度比一定的条件下,能进一步提高HCl转化率的方法是:____ (写出2种方法)。
(4)一定温度下,当进料比n(HCl):n(O2)=8:3时,若平衡时HCl的转化率为50%,体系的总压为PkPa。计算该温度下反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的压强平衡常数Kp=
2Cl2(g)+2H2O(g)的压强平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)350℃时,若某密闭容器中氯化氢催化氧化制氯气的反应的平衡常数K=25.0(mol·L-1)-1(以平衡浓度表示的平衡常数),正反应速率v正=k正c4(HCl)•c(O2),逆反应速率v逆=k逆c2(Cl2)•c2(H2O),其中k正、k逆为速率常数,则k逆=____ (用含K和k正的式子表示);若k正=0.45(mol·L-1)-4·min-1,40min时反应达到平衡状态,c(Cl2)=c(H2O)=0.5mol·L-1,v逆=___ mol·L-1·min-1。
(1)Deacon过程是最早也是最具有代表性的催化氧化法,由Deacon在1875年首先提出。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
CuCl(s)+
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3
其中,△H3=
(2)关于氯化氢催化氧化法制氯气的反应,下列说法正确的是
| A.催化氧化反应(Deacon制氯法)中,所使用的催化剂是CuCl |
| B.容器内气体的颜色不再变化时,说明该反应达到平衡状态 |
| C.反应达到平衡后,降低温度,能加快正反应速率,减小逆反应速率,使平衡正向移动 |
| D.其他条件一定时,氧气的投料越多,平衡时Cl2的体积分数越大 |

(4)一定温度下,当进料比n(HCl):n(O2)=8:3时,若平衡时HCl的转化率为50%,体系的总压为PkPa。计算该温度下反应:4HCl(g)+O2(g)
(5)350℃时,若某密闭容器中氯化氢催化氧化制氯气的反应的平衡常数K=25.0(mol·L-1)-1(以平衡浓度表示的平衡常数),正反应速率v正=k正c4(HCl)•c(O2),逆反应速率v逆=k逆c2(Cl2)•c2(H2O),其中k正、k逆为速率常数,则k逆=
丙烯是产量仅次于乙烯的重要基本有机原料之一,丙烷脱氢制丙烯技术已经工业化。
I.无氧脱氢法:C3H8(g)⇌C3H6(g)+H2(g) ∆H1=+124.3kJ/mol
(1)制丙烯的部分反应历程如图所示(TS代表过渡态,Pt4代表铂催化剂)。
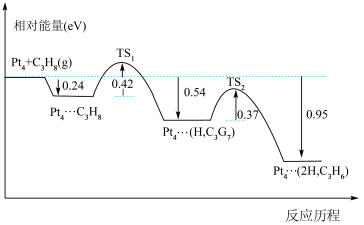
由图可知,该反应的限速步骤是第___________ (填“一”或“二”)个C-H断键的反应。有利于该反应自发进行的条件是___________ (填“高温”“低温”或“任意温度”)。
(2)在压强分别为0.1MPa和0.01MPa的条件下,在密闭容器中充入等量的C3H8,发生脱氢反应,C3H8和C3H6的平衡时物质的量分数随温度的变化如图所示。
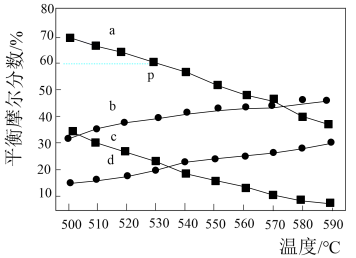
①在a、b、c、d四条直线中,分别表示0.01MPa时C3H8和C3H6物质的量分数的是___________ 、___________ 。
②p点对应的平衡常数Kp=___________ MPa(以分压表示,分压=总压×物质的量分数)。
Ⅱ.氧化脱氢法:C3H8(g)+ O2(g)⇌C3H6(g)+H2O(g) △H1=-117.0kJ/mol
O2(g)⇌C3H6(g)+H2O(g) △H1=-117.0kJ/mol
(3)在催化剂作用下,相同时间内,不同温度下C3H8氧化脱氢的转化率和C3H6的产率如下:
①C3H8的转化率随温度升高而上升的原因是___________ (答出1条即可)。
②已知:C3H6选择性= ×100%。随着温度升高,C3H6的选择性
×100%。随着温度升高,C3H6的选择性___________ (填“升高”“降低”或“不变”),可能的原因是___________ 。
I.无氧脱氢法:C3H8(g)⇌C3H6(g)+H2(g) ∆H1=+124.3kJ/mol
(1)制丙烯的部分反应历程如图所示(TS代表过渡态,Pt4代表铂催化剂)。

由图可知,该反应的限速步骤是第
(2)在压强分别为0.1MPa和0.01MPa的条件下,在密闭容器中充入等量的C3H8,发生脱氢反应,C3H8和C3H6的平衡时物质的量分数随温度的变化如图所示。

①在a、b、c、d四条直线中,分别表示0.01MPa时C3H8和C3H6物质的量分数的是
②p点对应的平衡常数Kp=
Ⅱ.氧化脱氢法:C3H8(g)+
(3)在催化剂作用下,相同时间内,不同温度下C3H8氧化脱氢的转化率和C3H6的产率如下:
| 反应温度/℃ | 465 | 480 | 495 | 510 |
| C3H8的转化率/% | 5.5 | 12.1 | 17.3 | 28.4 |
| C3H6的产率/% | 4.7 | 9.5 | 12.8 | 18.5 |
②已知:C3H6选择性=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网