填空题 适中0.65 引用1 组卷66
回答下列问题
(1)在高温、高压、催化剂作用下,1 mol石墨转化为金刚石,吸收1.9 kJ的热量,则___________ (选填“石墨”或“金刚石”)更稳定。
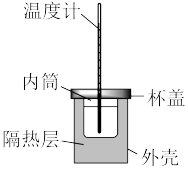
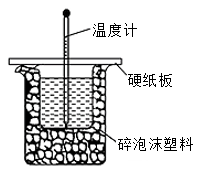
(2)用50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
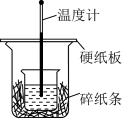
①从实验装置上看,图中缺少的一种实验仪器名称是___________ 。
②使用如图所示装置测得中和热
___________ (填“偏大、偏小、无影响”)。
(3)在25℃、101 kPa下,1 g 完全燃烧生成
完全燃烧生成 和液态水时放热22.68 kJ。写出表示
和液态水时放热22.68 kJ。写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式___________ 。
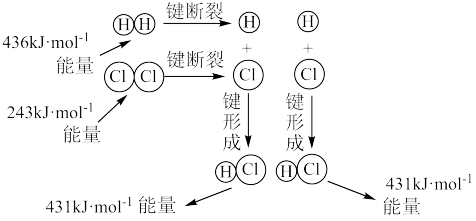
(4)用 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
①
 kJ·mol-1
kJ·mol-1
②
 kJ·mol-1
kJ·mol-1
据此,写出 将
将 还原为
还原为 的热化学方程式:
的热化学方程式:___________ 。
(1)在高温、高压、催化剂作用下,1 mol石墨转化为金刚石,吸收1.9 kJ的热量,则
(2)用50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:

①从实验装置上看,图中缺少的一种实验仪器名称是
②使用如图所示装置测得中和热
(3)在25℃、101 kPa下,1 g
(4)用
①
②
据此,写出
23-24高二上·重庆沙坪坝·阶段练习
类题推荐
Ⅰ.完成下列填空
(1)已知在25℃、101kPa下,1g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7kJ的热量,试写出乙醇燃烧热的热化学方程式___________
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
2H2+O2(g)=2H2O(l) ΔH2=-517.6kJ/mol
2C2H2+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol
计算25℃时,由C(石墨,s)和H2(g)反应生成C2H2(g)的热化学方程式为___________ 。
Ⅱ.分别取50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
(3)下图装置缺少一种玻璃仪器,该仪器的名称为___________ ;若用铜棒代替该仪器,会导致ΔH计算结果___________ (偏低、偏高或无影响),原因是___________ 。
(4)某学生实验记录数据如下:(已知ρ溶液=1g/cm3,c溶液=4.18J/(g·℃)),依据该学生的实验数据计算,该实验测得的中和热为ΔH=___________ 。(保留小数点后1位)
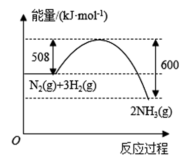
Ⅲ.2SO2(g)+O2(g) 2SO3(g) △H反应过程的能量变化如图所示。已知:1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
2SO3(g) △H反应过程的能量变化如图所示。已知:1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
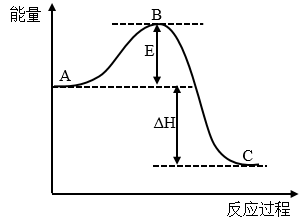
(5)图中A表示___________ 的能量(选用SO2、O2、SO3填空)。E的大小对该反应的反应热___________ (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___________ (填“升高”还是“降低”),△H___________ (填“变大”、“变小”或“不变”)。
(6)题中反应的中△H=___________ kJ·mol-1。
(1)已知在25℃、101kPa下,1g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7kJ的热量,试写出乙醇燃烧热的热化学方程式
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
2H2+O2(g)=2H2O(l) ΔH2=-517.6kJ/mol
2C2H2+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol
计算25℃时,由C(石墨,s)和H2(g)反应生成C2H2(g)的热化学方程式为
Ⅱ.分别取50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
(3)下图装置缺少一种玻璃仪器,该仪器的名称为

(4)某学生实验记录数据如下:(已知ρ溶液=1g/cm3,c溶液=4.18J/(g·℃)),依据该学生的实验数据计算,该实验测得的中和热为ΔH=
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
Ⅲ.2SO2(g)+O2(g)

(5)图中A表示
(6)题中反应的中△H=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网