解答题-原理综合题 较难0.4 引用1 组卷120
氮是地球上含量丰富的一种元素,氮及其化合物对我们的生产、生活有重要的影响。请回答下列问题:
I.利用化学原理对氮氧化物进行处理。
(1) 还原法消除氮氧化物,已知:
还原法消除氮氧化物,已知:
 ,
, 的燃烧热
的燃烧热 ,在催化剂存在下,
,在催化剂存在下, 还原
还原 生成液态水和氮气的热化学方程式为
生成液态水和氮气的热化学方程式为___________ 。
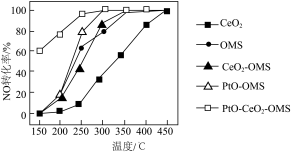
(2)汽车中的三元催化器能使尾气中的NO和CO发生反应转化为无污染的气体,主要反应的化学方程式为 。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为
。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为___________ 、___________ 。
Ⅱ.某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
a.

b.

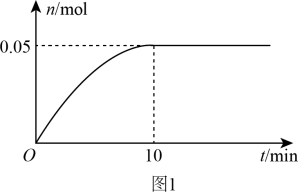
(3) 温度时,在2L的恒容密闭容器中投入0.05mol
温度时,在2L的恒容密闭容器中投入0.05mol 并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:
并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:
①下列情况能说明体系达到平衡状态的是___________ (填字母)。
A.混合气体的平均相对分子质量不再改变 B. 的质量不再改变
的质量不再改变
C.混合气体的密度不再改变 D. 的浓度不再改变
的浓度不再改变
②若达到平衡时,混合气体的总压强 ,反应开始到5min内
,反应开始到5min内 的平均反应速率为
的平均反应速率为___________  。在该温度下
。在该温度下 的平衡常数
的平衡常数
___________  (结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数
(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数 ,组分的分压
,组分的分压 平衡时总压
平衡时总压 该组分的体积分数
该组分的体积分数 ]。
]。
③实验测得 ,
, ,
, 、
、 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 、
、 的数学关系是
的数学关系是
___________ 。若将容器的温度改变为 时,其
时,其 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
I.利用化学原理对氮氧化物进行处理。
(1)
(2)汽车中的三元催化器能使尾气中的NO和CO发生反应转化为无污染的气体,主要反应的化学方程式为

Ⅱ.某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
a.
b.
(3)
①下列情况能说明体系达到平衡状态的是
A.混合气体的平均相对分子质量不再改变 B.
C.混合气体的密度不再改变 D.
②若达到平衡时,混合气体的总压强
③实验测得
23-24高二上·福建福州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网