解答题-实验探究题 适中0.65 引用1 组卷87
某小组学生研究常见的金属腐蚀现象,分析其原理。按要求回答下列问题。
(1)化学反应速率由快到慢的顺序为___________________ 。(填序号,下同)探究浓度对化学反应速率影响的是___________ ;探究温度对化学反应速率影响的是___________ ;①③探究___________ 对化学反应速率影响。某同学查资料得知向上面的实验体系中加入硫酸铜固体能加快反应速率,其原因为___________ 。
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。
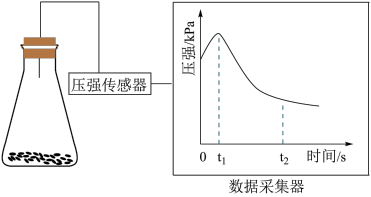
①0~ 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为___________ 。
② ~
~ 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为___________ 。
③0~ 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为___________ 。
(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
①暖贴工作时,铁粉发生的反应为___________ (填“氧化反应”或“还原反应”)。
②暖贴发热时,正极材料为___________ ;食盐的作用为___________ 。
③当暖贴放热结束时,铁粉转化成的物质中可能含有___________ 。(填两种物质)
| 实验 | ① | ② | ③ | ④ |
| 浓度 | 50mL 4mol /L | 50mL 2mol/L | 50mL 4mol/L | 50mL 4mol/L |
| 温度/℃ | 20 | 20 | 20 | 40 |
| 固体形状 |
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。

①0~
②
③0~
(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
| 品名:一次性保暖贴 主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂 产品性能:平均温度55,最高温度63,发热时间12小时以上 |
②暖贴发热时,正极材料为
③当暖贴放热结束时,铁粉转化成的物质中可能含有
23-24高二上·福建福州·期中
类题推荐
H2O2被称为绿色氧化剂,其性质的研究极其重要。
I.某市售H2O2溶液中含H2O2的质量分数为30%,密度1.11g/mL,回答下列问题。
(1)H2O2中氧的化合价为_______ ,该市售双氧水溶液中H2O2的物质的量浓度_______ 。(结果保留2位小数)
II.某同学以H2O2分解为例,按照表中数据探究温度、浓度、催化剂、酸对反应速率的影响。
(2)在实验①和②中,H2O2分解速率较快的是_______ ,实验②和③的目的是_______ ;
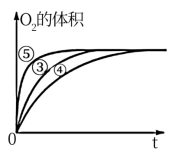
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能够得出的实验结论是_______ 。
III. 如图:另一个同学将状态不同的1 g MnO2分别加入盛有30 mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如表:

(4)锥形瓶中发生反应的化学方程式_______ ,该反应是_______ 反应(填“放热”或“吸热”),装置a的名称_______ ,实验结果表明,催化剂的催化效果与_______ 有关。
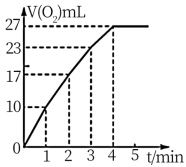
(5)实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因_______ 。
I.某市售H2O2溶液中含H2O2的质量分数为30%,密度1.11g/mL,回答下列问题。
(1)H2O2中氧的化合价为
II.某同学以H2O2分解为例,按照表中数据探究温度、浓度、催化剂、酸对反应速率的影响。
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 20 mL 2% H2O2溶液+2 mL H2O | 无 | 20℃ |
| ② | 20 mL 5% H2O2溶液+2 mL H2O | 无 | 20℃ |
| ③ | 20 mL 5% H2O2溶液+2 mL H2O | 1g粉末状MnO2 | 20℃ |
| ④ | 20 mL 5% H2O2溶液+2 mL 1 mol/L HCl溶液 | 1g粉末状MnO2 | 20℃ |
| ⑤ | 20 mL5% H2O2溶液+2 mLH2O | 1g粉末状MnO2 | 40℃ |
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能够得出的实验结论是

III. 如图:另一个同学将状态不同的1 g MnO2分别加入盛有30 mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如表:

| MnO2状态 | 触摸试管情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3 min |
| 块状 | 微热 | 30mL | 9 min |
(5)实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因

广安友谊中学高二某班学生为了研究外界条件对化学反应速率的影响设计了如下一系列的实验:收集产生的气体,记录获得相同体积的气体所需时间。
(1)①②④中化学反应速率由大到小的顺序为______________ (填序号)
(2)探究浓度对化学反应速率影响的是______________ (填序号);探究温度对化学反应速率影响的是______________ (填序号);①③探究__________ 对化学反应速率影响
(3)某同学查资料得知向上面的实验中加入硫酸铜固体能加快反应速率,其原因为_________________________ 。
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=_______ ,V6=_______ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________________________________ 。
| 实验 | ① | ② | ③ | ④ |
| 50mL4 mol/L H2SO4 | 50mL2 mol/L H2SO4 | 50mL4 mol/L H2SO4 | 50mL4 mol/L H2SO4 | |
| 20℃ | 20℃ | 20℃ | 40℃ | |
| 6.5g块状Zn | 6.5g块状Zn | 6.5g粉末状Zn | 6.5g块状Zn |
(2)探究浓度对化学反应速率影响的是
(3)某同学查资料得知向上面的实验中加入硫酸铜固体能加快反应速率,其原因为
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
红岭中学高二某班学生为了研究外界条件对化学反应速率的影响设计了如下一系列的实验,在实验过程中收集产生的气体,并记录获得相同体积的气体所需时间。
(1)①②④中化学反应速率由快到慢的顺序为_______ (填序号,下同)。
(2)探究浓度对化学反应速率影响的实验是_______ ;探究温度对化学反应速率影响的实验是_______ 。影响反应速率的最根本因素是_______
(3)某同学查资料得知向上面的实验体系中加入少量硫酸铜固体能加快反应速率,其原因为_______ 。
| 实验 | ① | ② | ③ | ④ |
| 浓度 | 50mL 4 | 50mL 2 | 50mL 4 | 50mL 4 |
| 温度/℃ | 20 | 20 | 20 | 40 |
| 固体形状 | 6.5g块状Zn | 6.5g块状Zn | 6.5g粉末状Zn | 6.5g块状Zn |
(2)探究浓度对化学反应速率影响的实验是
(3)某同学查资料得知向上面的实验体系中加入少量硫酸铜固体能加快反应速率,其原因为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


