解答题-原理综合题 较难0.4 引用2 组卷202
氨的用途十分泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为___________ kJ/mol。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是___________ (填选项序号)。
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
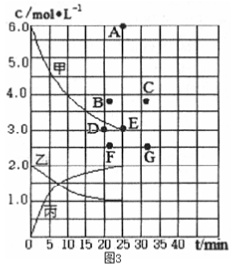
(4)一定温度下,向2L恒容密闭容器中充入0.4molN2、1.2molH2发生反应,NH3的浓度随时间变化情况如表所示:
0~10min内,用H2表示的平均反应速率为___________ ;实验测得体系平衡时的压强为10MPa,则该反应的平衡常数Kp=___________ MPa-2(用分数表示,Kp为分压表示的平衡常数,分压=总压×体积分数);若维持温度不变,向另一2L恒容密闭容器中充入H2、N2和NH3各4mol时,该反应的v正___________ (填“>”“<”或“=”)v逆。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A.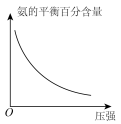 | B.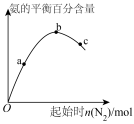 |
C.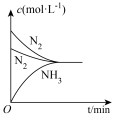 | D. |
| 时间/min | 5 | 10 | 15 | 20 | 25 |
| 浓度/mol/L | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
23-24高三上·河北石家庄·期中
类题推荐
氨的用途十分广泛,是现代工业、农业生产最基础的化工原料之一。
I.以氨为原料可生产尿素:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
①2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1
②NH2COONH4(l) CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是_______ (填“①”或“②”)。
(2)总反应的ΔH=_______ 。
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
(3)上述反应在常温下_______ (填“能”或“不能”)自发进行。
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
(5)科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入6mol N2和10mol H2,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
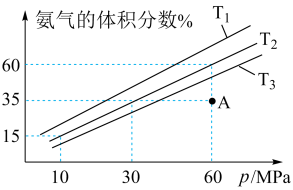
①T1、T2、T3由小到大的顺序为_______ 。
②在T2、60MPa条件下,平衡时N2的转化率为_______ %;(体积分数=物质的量分数)
(6)恒温下,往一个4 L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
10 min内用N2表示的平均反应速率为_______ mol·L-1·min-1。此条件下该反应的化学平衡常数K=_______ 。
I.以氨为原料可生产尿素:2NH3(g)+CO2(g)
①2NH3(g)+CO2(g)
②NH2COONH4(l)
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是
(2)总反应的ΔH=
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g)
(3)上述反应在常温下
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
| A.容器内气体的平均摩尔质量不变 | B.N2的体积分数不变 |
| C.混合气体的颜色不再改变 | D.3v正(NH3)=2v逆(H2) |

①T1、T2、T3由小到大的顺序为
②在T2、60MPa条件下,平衡时N2的转化率为
(6)恒温下,往一个4 L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
碳和氮的化合物在生产、生活中广泛存在。回答下列问题:
(1)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.0 mol N2和6.0 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示。
该温度下,若向同容积的另一容器中充入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正___________ (填“大于”“小于”或“等于”)v逆。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。
N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。___________ ;在1100 K时,CO2的体积分数为___________ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050 K、1.1×106 Pa时,该反应的化学平衡常数Kp=___________ [已知:气体分压(p分)=气体总压(p总)×体积分数]。
(1)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.0 mol N2和6.0 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示。
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.0 | 4.5 | 3.6 | 3.3 | 3.03 | 3.0 | 3.0 |
| n(NH3)/mol | 0 | 1.0 | 1.6 | 1.8 | 1.98 | 2.0 | 2.0 |
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)
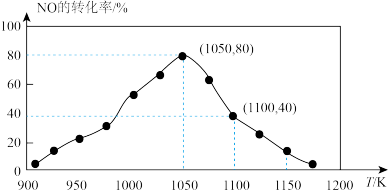
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050 K、1.1×106 Pa时,该反应的化学平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NH3(g)
2NH3(g)