解答题-工业流程题 适中0.65 引用1 组卷171
从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。
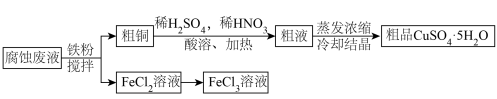
(1)上述流程中能加快反应速率的措施有___________ 。
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中 浓度过小,原因是
浓度过小,原因是________ (用离子方程式表示),不能得到硝酸铜晶体。
②粗液中 浓度较大,但由于
浓度较大,但由于___________ ,不能得到硝酸铜晶体。
(3)测量粗品CuSO4·5H2O中铁(含Fe2+、Fe3+)的含量,评定纯度等级。
I.用水溶解一定质量粗品,加入稀H2SO4和H2O2溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至pH=11。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀HCl溶解红褐色沉淀,滴入KSCN溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知:Cu2+完全沉淀的pH为6.7,Fe3+完全沉淀的pH为2.8
①I中将Fe2+氧化为Fe3+的离子方程式是___________ 。
②试剂X选用___________ (填字母序号)。
a、氨水 b、NaOH溶液

(1)上述流程中能加快反应速率的措施有
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中
②粗液中
(3)测量粗品CuSO4·5H2O中铁(含Fe2+、Fe3+)的含量,评定纯度等级。
I.用水溶解一定质量粗品,加入稀H2SO4和H2O2溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至pH=11。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀HCl溶解红褐色沉淀,滴入KSCN溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知:Cu2+完全沉淀的pH为6.7,Fe3+完全沉淀的pH为2.8
①I中将Fe2+氧化为Fe3+的离子方程式是
②试剂X选用
a、氨水 b、NaOH溶液
23-24高二上·北京朝阳·期中
类题推荐
某工业生产上用铜镍矿石(主要成分为CuS、NiS、FeS、SiO2及不溶于酸的杂质)制备胆矾CuSO4•5H2O的流程如图。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org) CuR2(org)+2H+(aq)。
CuR2(org)+2H+(aq)。
(1)焙烧前粉碎的目的是_______ 。
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为_______ ,试剂X的最佳选择是_______ (填标号)。
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
该滤液的pH为_______ ;加入的Cu(OH)2_______ (填“已经”或“没有”)完全溶解。
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为_______ 。
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为_______ 。
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是_______ 。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org)
(1)焙烧前粉碎的目的是
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
| 离子 | Fe3+ | Cu2+ | Ni2+ | Fe2+ |
| 浓度/(mol·L-1) | 1.0×10-6 | 5.0 | 1.2 | 0 |
| 对应氢氧化物的Ksp | 6.4×10-38 | 2.2×10-20 | 2.0×10-15 | 8.0×10-16 |
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




