解答题-原理综合题 较难0.4 引用3 组卷433
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷和 为原料制取氢气是工业上常用的制氢方法。
为原料制取氢气是工业上常用的制氢方法。
已知:

①甲烷与 制取氢气时,常向反应器中通入一定比例空气,其目的是
制取氢气时,常向反应器中通入一定比例空气,其目的是___________ 。
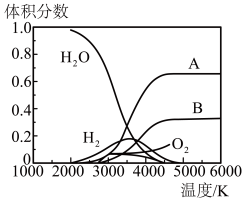
② 的热分解也可得到
的热分解也可得到 ,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是
,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是___________ 。 的电化学储氢(忽略其它有机物的反应)。
的电化学储氢(忽略其它有机物的反应)。 与
与 的相互转化实现
的相互转化实现 的储存与释放,其释放
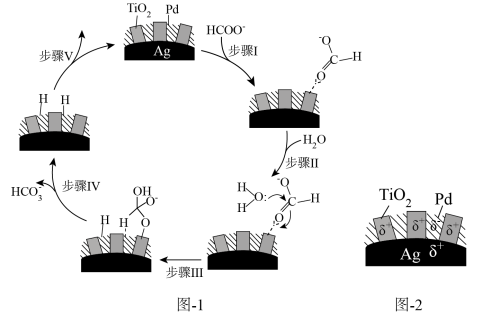
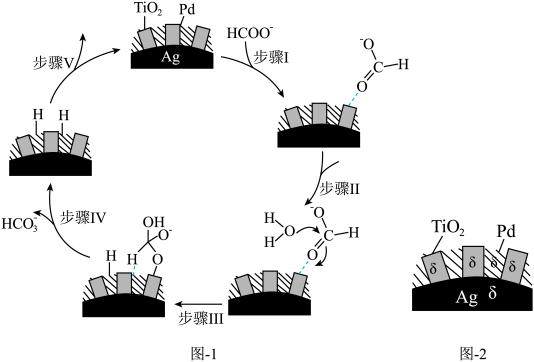
的储存与释放,其释放 的一种机理如图-1所示,该过程中使用的
的一种机理如图-1所示,该过程中使用的 复合催化剂的结构及各部分所带电荷如图-2所示。
复合催化剂的结构及各部分所带电荷如图-2所示。___________ 。
②根据元素电负性的变化规律,步骤Ⅱ、Ⅲ可以描述为___________ ,1个氢氧键断裂后带正电的氢与催化剂表面带负电的Pd成键。
③70~80℃,利用相同的催化剂,调节压强能够实现上述释氢的逆转化,达到储氢的目的。从能源利用、环境保护和物质转化角度分析,该储氢与(2)中电化学储氢方法相比,其优点有___________ 。
(1)以甲烷和
已知:
①甲烷与
②
 的电化学储氢(忽略其它有机物的反应)。
的电化学储氢(忽略其它有机物的反应)。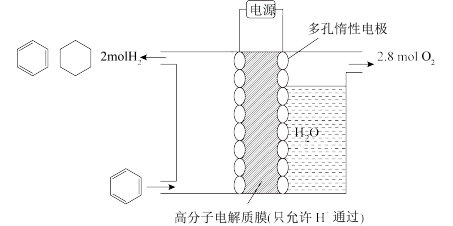
①写出由 生成
生成 的电极反应式:
的电极反应式:
②该装置的电流效率 ×100%)
×100%)
②根据元素电负性的变化规律,步骤Ⅱ、Ⅲ可以描述为
③70~80℃,利用相同的催化剂,调节压强能够实现上述释氢的逆转化,达到储氢的目的。从能源利用、环境保护和物质转化角度分析,该储氢与(2)中电化学储氢方法相比,其优点有
23-24高三上·江苏苏州·期中
类题推荐
氢气的制取与储存是氢能源利用领域的研究热点。近年来 催化重整制氢是氢能源获取的重要途径,主要反应如下:
催化重整制氢是氢能源获取的重要途径,主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
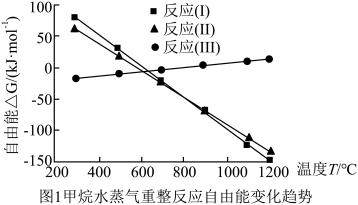
甲烷水蒸气重整过程中自由能( ,设
,设 和
和 不随温度变化)随温度变化趋势如图1所示:
不随温度变化)随温度变化趋势如图1所示:
_____________ 0(填“ ”或“
”或“ ”),理由是
”),理由是_____________________ 。
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是 。
(3)一定温度下,向恒容密闭反应器中通入 和
和 ,起始时
,起始时 和
和 的分压分别为
的分压分别为 ,发生反应Ⅰ、Ⅱ、Ⅲ。反应进行
,发生反应Ⅰ、Ⅱ、Ⅲ。反应进行 时达到平衡状态,此时
时达到平衡状态,此时 的分压分别为
的分压分别为 。
。
① 的平衡分压为
的平衡分压为_________________  (用含
(用含 ,
, 的代数式表示,下同)。
的代数式表示,下同)。
②反应Ⅰ的
_________________ (用平衡时各物质的分压代替物质的量浓度)。
(4) ,利用
,利用 与
与 的相互转化实现
的相互转化实现 的储存与释放,其释放
的储存与释放,其释放 的一种机理如图-1所示,该过程中使用的
的一种机理如图-1所示,该过程中使用的 复合催化剂的结构及各部分所带电荷如图-2所示。
复合催化剂的结构及各部分所带电荷如图-2所示。_________________________________ 。
②根据元素电负性的变化规律,步骤Ⅰ、Ⅱ可以描述为_________________ 。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
甲烷水蒸气重整过程中自由能(
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是 。
| A.及时分离出二氧化碳,可以使得反应Ⅰ的正反应速率增大 |
| B.降低温度,反应Ⅰ逆向移动,反应Ⅲ正向移动 |
| C.加入反应Ⅲ的催化剂,可以降低该反应的活化能和反应热 |
| D.增大水蒸气的浓度,有利于提高甲烷的平衡转化率 |
(3)一定温度下,向恒容密闭反应器中通入
①
②反应Ⅰ的
(4)
②根据元素电负性的变化规律,步骤Ⅰ、Ⅱ可以描述为
氢气的制取与储存是氢能源利用领域的研究热点。CH4-H2O(g)催化重整制氢,主要反应如下:
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:
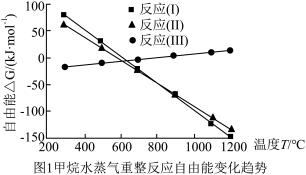
(1)反应Ⅱ焓变的符号:∆H2_______ 0(填“>”或“<”),理由是_______ 。
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是_______ 。
(3)反应Ⅲ的速率v=v正-v逆=k正c(CO)•c(H2O)-k逆c(CO2)•c(H2),其中k正、k逆分别为正、逆反应速率常数。升高温度时lgk正-lgk逆_______ (填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为_______ MPa(用含a、b的代数式表示,下同)。
②反应I的Kp=_______ (用平衡时各物质的分压代替物质的量浓度)。
(5)70~80℃,利用HCO 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
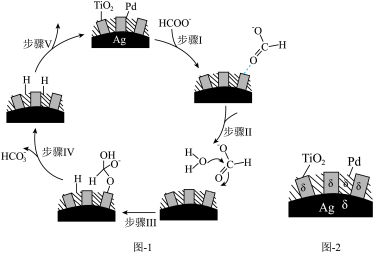
①写出释氢反应的离子方程式:_______ 。
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为_______ 。
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:

(1)反应Ⅱ焓变的符号:∆H2
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是
| A.及时分离出二氧化碳,可以使得反应I的正反应速率增大 |
| B.降低温度,反应I逆向移动,反应Ⅲ正向移动 |
| C.加入反应Ⅲ的催化剂,可以降低该反应的活化能和反应热 |
| D.增大水蒸气的浓度,有利于提高甲烷的平衡转化率 |
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为
②反应I的Kp=
(5)70~80℃,利用HCO

①写出释氢反应的离子方程式:
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




