解答题-实验探究题 适中0.65 引用3 组卷411
三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室用 和
和 (沸点76.8℃)在高温下制备无水
(沸点76.8℃)在高温下制备无水 ,同时生成
,同时生成 气体。实验装置(加热及夹持装置略)如图所示。
气体。实验装置(加热及夹持装置略)如图所示。
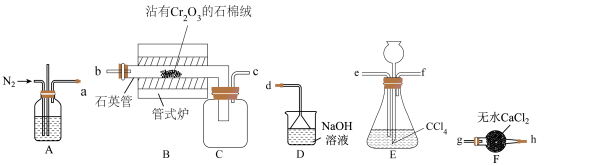
已知: 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
回答下列问题:
(1)实验装置合理的连接顺序为a→___________ →d。
(2)制备 时进行操作:(i)连接装置,……;(ii)装入药品并通入
时进行操作:(i)连接装置,……;(ii)装入药品并通入 ;加热石英管至400℃;(ⅲ)停止通入
;加热石英管至400℃;(ⅲ)停止通入 ,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入
,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入 一段时间;(vi)装置冷却后,结束制备实验。
一段时间;(vi)装置冷却后,结束制备实验。
①补全步骤i的操作___________ 。
②实验过程中为了形成稳定的 气流,对E装置加热的最佳方式是
气流,对E装置加热的最佳方式是___________ ,装置E中长颈漏斗的作用是___________ 。
③步骤v中“继续通入 一段时间”的目的是
一段时间”的目的是___________ 。
(3)装置D中反应的离子方程式为___________ 。
(4)测定 产品的纯度,实验如下:
产品的纯度,实验如下:
①取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
②冷却后,滴入适量的稀硫酸和浓磷酸,使 转化为
转化为 ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;
③取25.00mL溶液,用新配制的 的
的 标准溶液滴定至终点,重复3次,平均消耗
标准溶液滴定至终点,重复3次,平均消耗 标准溶液VmL(已知
标准溶液VmL(已知 被
被 还原为
还原为 )。
)。
则样品中 (摩尔质量为
(摩尔质量为 )的质量分数为
)的质量分数为___________ %;若步骤③中所用标准溶液已变质,将导致 质量分数测定值
质量分数测定值___________ (填“偏高”、“偏低”或“无影响”)。

已知:
回答下列问题:
(1)实验装置合理的连接顺序为a→
(2)制备
①补全步骤i的操作
②实验过程中为了形成稳定的
③步骤v中“继续通入
(3)装置D中反应的离子方程式为
(4)测定
①取
②冷却后,滴入适量的稀硫酸和浓磷酸,使
③取25.00mL溶液,用新配制的
则样品中
23-24高三上·山东烟台·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






