填空题 适中0.65 引用2 组卷221
随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:






则:

___________ kJ/mol。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(3)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。

②工业上利用CO和 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:
设CO以 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为___________ 。
(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:
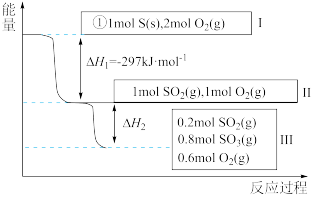
已知:

①表示硫的燃烧热的热化学方程式为___________ 。
②图中
___________ kJ/mol。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
则:
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
(3)甲醇是一种新型的汽车动力燃料。
①以

②工业上利用CO和
| 化学键 | ||||||
| 键能/ | 348 | 413 | 436 | 358 | 1072 | 463 |
(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:

已知:
①表示硫的燃烧热的热化学方程式为
②图中
23-24高二上·河南开封·期中
类题推荐
化学反应中均伴随有能量变化。回答下列问题:
(1)下列反应中,反应物的总能量小于生成物的总能量的是___________ (填选项字母)。
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
①表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
②36g 分解生成
分解生成 和
和
___________ (填“吸收”或“放出”)___________ kJ的热量。
(3)已知反应:


写出氨气和氧气反应生成NO2和水蒸气的热化学方程式___________ (用 、
、 、
、 、
、 表示反应的
表示反应的 )
)
(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(5)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。
设CO以C≡O键构成,则工业制备甲醇的热化学方程式为___________ 。
(1)下列反应中,反应物的总能量小于生成物的总能量的是
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
| 物质 | ||||
| 相对能量(kJ·mol-1) | 0 | 0 | -242 | -286 |
②36g
(3)已知反应:
写出氨气和氧气反应生成NO2和水蒸气的热化学方程式
(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
(5)甲醇是一种新型的汽车动力燃料。
①以
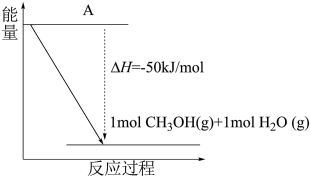
②工业上利用CO和H2来制备甲醇(CH3OH,结构式为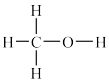 )气体。已知某些化学键的键能数据如下表:
)气体。已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=_____ kJ·mol-1。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____ kJ。
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
则该反应的ΔH=____ kJ·mol-1。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。
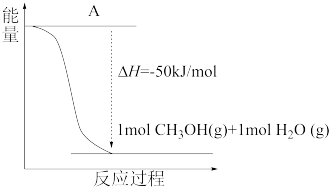
补全上图:图中A处应填入_______ 。
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。
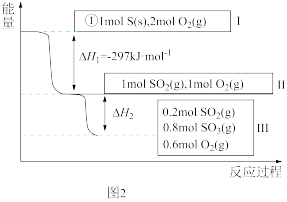
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:____ 。
②ΔH2=___ kJ·mol-1。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。

补全上图:图中A处应填入
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。

已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
硅有望成为未来的新能源。回答下列问题:
(1)硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)ΔH=-989.32kJ·mol-1。有关键能数据如下表所示:
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,表中x=______ 。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把_______ 能转化为_________ 能的装置。
(3)下列对硅作为未来新能源的认识错误的是_________ (填标号)。
A.硅是固体燃料,便于运输、贮存
B.硅的来源丰富,易于开采且可再生
C.硅燃烧放出的热量大,其燃烧产物对环境污染程度低且易控制
D.自然界中存在大量的单质硅
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在制备纯硅的反应过程中________ (填“吸收”或“放出”)的热量为_______ kJ。
(1)硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)ΔH=-989.32kJ·mol-1。有关键能数据如下表所示:
| 化学键 | Si—O | O=O | Si—Si |
| 键能/(kJ·mol-1) | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,表中x=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把
(3)下列对硅作为未来新能源的认识错误的是
A.硅是固体燃料,便于运输、贮存
B.硅的来源丰富,易于开采且可再生
C.硅燃烧放出的热量大,其燃烧产物对环境污染程度低且易控制
D.自然界中存在大量的单质硅
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在制备纯硅的反应过程中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


