解答题-原理综合题 适中0.65 引用1 组卷46
回答下列问题
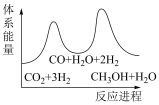
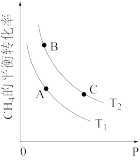
(1)“碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:

①反应I的活化能Ea(正)___________ Ea(逆)(填“>”“<”或“=”)。
②反应 的∆H=
的∆H=___________ kJ·mol-1,K=___________ (用K1、K2表示)。
③在T温度下,将6molCH4(g)和8molCO2(g)充入2L的恒容密闭容器中,若只发生I的反应,平衡时H2(g)的物质的量为4mol,此时CO2(g)的转化率为___________ ;T温度时反应I的平衡常数K为___________ 。若发生反应I和Ⅱ,达到平衡状态时H2(g)和H2O(g)的物质的量均为2mol。此时CO2(g)转化率为___________ ;则T温度时反应I的平衡常数K为___________ 。
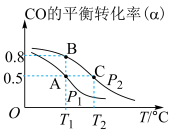
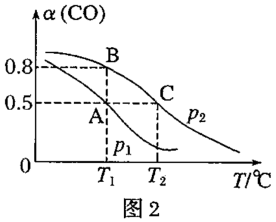
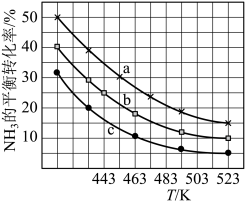
(2)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为 。在一容积可变的密闭容器中,充有10molCO和20molH2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
。在一容积可变的密闭容器中,充有10molCO和20molH2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
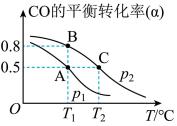
①上述合成甲醇的反应为___________ 反应(填“放热”或“吸热”)。
②平衡常数KA、KB、KC的大小关系为___________ 。
③若达到平衡状态A时容器的体积为10L,则平衡状态B时容器的体积为___________ L。
(1)“碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①反应I的活化能Ea(正)
②反应
③在T温度下,将6molCH4(g)和8molCO2(g)充入2L的恒容密闭容器中,若只发生I的反应,平衡时H2(g)的物质的量为4mol,此时CO2(g)的转化率为
(2)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为

①上述合成甲醇的反应为
②平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时容器的体积为10L,则平衡状态B时容器的体积为
23-24高二上·安徽合肥·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
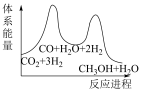 B.
B.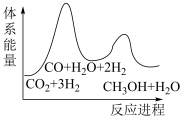
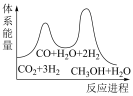 D.
D.