解答题-原理综合题 较难0.4 引用2 组卷134
甲烷、二氧化碳都是“碳一化学”的重要成员,在工业生产中应用广泛。回答下列问题:
(1)利用甲烷可实现 的消除。
的消除。
已知:甲烷的燃烧热(25℃、101kPa)为890.3
反应ⅰ.


反应ⅱ.


则消除 的反应:
的反应:

___________ 。反应 的
的
___________ (用含 、
、 的式子表示)。
的式子表示)。
(2)现向一密闭容器中充入一定量的 (g)和
(g)和 (g),保持总压为160kPa,发生反应:
(g),保持总压为160kPa,发生反应:
 。
。
①能表示该反应已经达到平衡状态的是___________ (填字母)。
A. B.混合气体的平均相对分子质量保持不变
B.混合气体的平均相对分子质量保持不变
C. 保持不变 D.甲烷与二氧化氮的转化率之比为1∶1
保持不变 D.甲烷与二氧化氮的转化率之比为1∶1
②若初始投料 ,
, 的平衡转化率与温度(T)的关系如图所示:
的平衡转化率与温度(T)的关系如图所示:
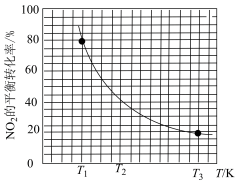
温度为 时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率
时,若反应从开始到平衡用时10min,则该时间段内用分压表示的平均反应速率
___________  ;该温度下反应的压强平衡常数
;该温度下反应的压强平衡常数
___________ (分压=总压×物质的量分数)。
(3)某团队合成的低配位Cu在碱性条件下催化 还原生成乙烯的电化学装置如图所示。
还原生成乙烯的电化学装置如图所示。
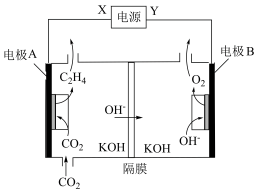
①Y为电源的___________ (填“正极”或“负极”)。
②电极A上消耗的 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为___________ 。
(1)利用甲烷可实现
已知:甲烷的燃烧热(25℃、101kPa)为890.3
反应ⅰ.
反应ⅱ.
则消除
(2)现向一密闭容器中充入一定量的
①能表示该反应已经达到平衡状态的是
A.
C.
②若初始投料

温度为
(3)某团队合成的低配位Cu在碱性条件下催化

①Y为电源的
②电极A上消耗的
23-24高三上·河南周口·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网