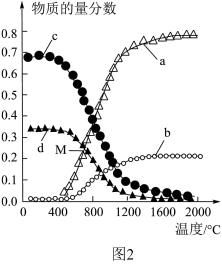
解答题-原理综合题 适中0.65 引用4 组卷88
氢能有燃烧热值高、可持续性、储量丰富、零污染等优点,是真正的绿色、清洁、可持续发展能源。下面是我国科学家研究的几种制氢方法。回答下列问题:
(1)水煤气法:发生反应的化学方程式为:
 。
。
①用物质的量浓度表示该反应的化学平衡常数表达式Kc=___________ 。升高温度Kc将___________ (填“变大”“变小”或“不变”)。
②在温度恒定的密闭容器中,加入一定量C(s)和2 mol H2O(g)达到平衡时压强为p,将容器体积缩小一半,此时v (正)___________ (填“大于”“小于”或“等于”)v(逆),再次达到化学平衡状态时压强为p1,则p1的范围为___________ 。
(2)化学硫碘循环分解水制氢气的总反应方程式为:
 。
。
反应原理简化为:
反应历程1:
反应历程2:
反应历程3:___________。
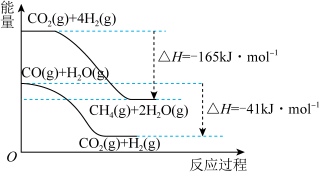
反应过程中能量变化如图所示:
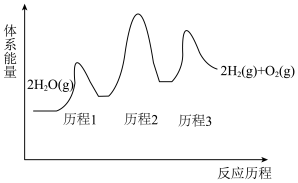
①写出反应历程3的化学方程式___________ 。
②该反应的催化剂是___________ (填化学式),化学硫碘循环分解水制得氢气过程中,决定反应速率快慢的步骤是反应历程___________ (填“1”“2”或“3”),该反应历程的△H_______ 0(填“<”“>”或“=”)
(3)甲烷水蒸气催化重整制得氢气,反应原理为:
I.

Ⅱ.

①为了提高CH4的平衡转化率,同时提高CO的浓度,可以采取的措施是_______ (填字母)。
A.使用高效催化剂 B.升高温度
C.增大压强 D.增大CH4和H2O(g)物质的量之比
②某温度下,在刚性密闭容器中加入1 mol CH4(g)和1molH2O(g),在催化剂作用下发生上述反应,达到平衡后测得n(H2O)=0.7mol,n(CO2)=0.1mol,则此温度下反应Ⅱ的化学平衡常数KⅡ=_______ 。
(1)水煤气法:发生反应的化学方程式为:
①用物质的量浓度表示该反应的化学平衡常数表达式Kc=
②在温度恒定的密闭容器中,加入一定量C(s)和2 mol H2O(g)达到平衡时压强为p,将容器体积缩小一半,此时v (正)
(2)化学硫碘循环分解水制氢气的总反应方程式为:
反应原理简化为:
反应历程1:
反应历程2:
反应历程3:___________。
反应过程中能量变化如图所示:

①写出反应历程3的化学方程式
②该反应的催化剂是
(3)甲烷水蒸气催化重整制得氢气,反应原理为:
I.
Ⅱ.
①为了提高CH4的平衡转化率,同时提高CO的浓度,可以采取的措施是
A.使用高效催化剂 B.升高温度
C.增大压强 D.增大CH4和H2O(g)物质的量之比
②某温度下,在刚性密闭容器中加入1 mol CH4(g)和1molH2O(g),在催化剂作用下发生上述反应,达到平衡后测得n(H2O)=0.7mol,n(CO2)=0.1mol,则此温度下反应Ⅱ的化学平衡常数KⅡ=
23-24高二上·河北张家口·阶段练习
类题推荐
工业上利用CO2和H2合成甲醇,既能减少温室气体排放,又能合成重要工业燃料。发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。其它条件不变时,反应相同时间CO2的转化率随温度T的变化情况如图所示。
CH3OH(g)+H2O(g) △H。其它条件不变时,反应相同时间CO2的转化率随温度T的变化情况如图所示。

回答下面问题:
(1)x点的v(正)____ v(逆)(填“大于”“小于”或“等于”,下同),x点的v(正)____ y点的v(逆),△H____ 0。
(2)在某体积不变的绝热刚性容器中发生上述反应,下列说法正确的是____ 。
(3)在一定温度和压强下,若原料气中的CO2和H2的物质的量之比 =M,如图是M与CH3OH平衡百分含量(a%)的关系。
=M,如图是M与CH3OH平衡百分含量(a%)的关系。
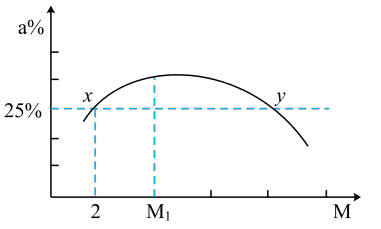
①M1=____ 。
②在平衡状态x点时,CO2的平衡转化率为____ %。
③在平衡状态y点时,用百分含量表示的平衡常数K=____ 。
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g) CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可以采取的措施是
CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可以采取的措施是____ 、____ (写出两点)。在某密闭容器中通入1molCO2和3molH2,在催化剂作用下,同时发生:①CO2(g)+3H2(g) CH3OH(g)+H2O(g)和②CO2(g)+H2(g)
CH3OH(g)+H2O(g)和②CO2(g)+H2(g) CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则反应②的化学平衡常数是
CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则反应②的化学平衡常数是____ (保留三位小数)。

回答下面问题:
(1)x点的v(正)
(2)在某体积不变的绝热刚性容器中发生上述反应,下列说法正确的是
| A.混合气体的密度不再发生变化时反应达到化学平衡状态 |
| B.混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc |
| C.该反应的化学反应速率随着反应的进行不断加快 |
| D.达到平衡后升高温度,气体压强增大,化学平衡可能正向移动 |
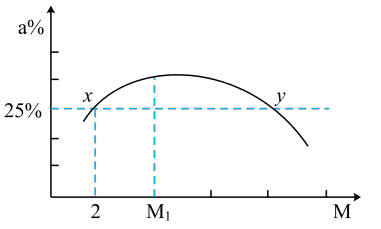
①M1=
②在平衡状态x点时,CO2的平衡转化率为
③在平衡状态y点时,用百分含量表示的平衡常数K=
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网