解答题-实验探究题 较难0.4 引用2 组卷632
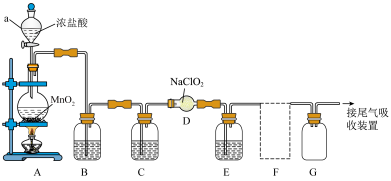
二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
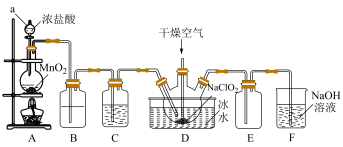
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
23-24高一上·宁夏银川·期中
类题推荐
无水FeCl2为黄绿色晶体,在空气中易被氧化、易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备:
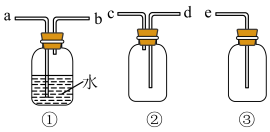
制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
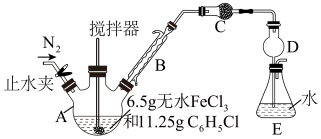
(1)仪器A的名称是___________ 。
(2)装置C中的试剂是______________________ (填化学式)。
II. 性质探究:将
性质探究:将 晶体配成溶液后进行如下实验。
晶体配成溶液后进行如下实验。
已知: 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 。
。
(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的 的浓度小;
的浓度小;
假设2:氯水氧化性强,___________ 。
取实验i中浅红色溶液,___________ (填实验操作),溶液浅红色消失,从而排除假设1;向 水中滴加
水中滴加 溶液,滴加
溶液,滴加 饱和氯水,加入
饱和氯水,加入___________ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是______________________ (用离子方程式表示,已知 中C元素为
中C元素为 价)。
价)。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl

(1)仪器A的名称是
(2)装置C中的试剂是
II.
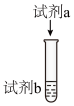
序号 | 装置 | 试剂b | 试剂a | 实验现象 |
实验i |
|
| 溶液立即变为浅红色 | |
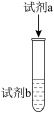
实验ii |
| 溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色 |
(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的
假设2:氯水氧化性强,
取实验i中浅红色溶液,
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
无水FeCl2为黄绿色晶体,在空气中易被氧化、易吸水,不溶于氯仿等有机溶剂。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。_______ ,作用是_______ 。
(2)装置C中的试剂是_______ (填化学式)。装置D的作用是_______ 。
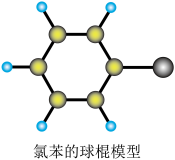
(3)氯苯(C6H5Cl)的球棍模型图,氯苯可由苯和氯气在催化剂条件下反应生成,其化学反应方程式为_______ ,反应类型是_______ 。
已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为 。
。
(4)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的 的浓度小;
的浓度小;
假设2:氯水氧化性强,_______ 。
取实验i中浅红色溶液,_____ (填实验操作),溶液浅红色消失,从而排除假设1;向2mL水中滴加5mL0.1mol·L−1KSCN溶液,滴加0.5mL饱和氯水,加入______ ,产生白色沉淀,说明假设2正确。
(5)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是_______ (用离子方程式表示,已知SCN-中C元素为+4价)。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl
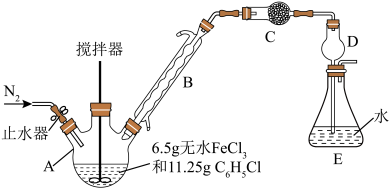
(2)装置C中的试剂是
(3)氯苯(C6H5Cl)的球棍模型图,氯苯可由苯和氯气在催化剂条件下反应生成,其化学反应方程式为
| 序号 | 装置 | 试剂b | 试剂a | 实验现象 |
| 实验i |
| 5mL0.1mol·L−1KSCN溶液、1mL0.1mol·L−1FeCl2(pH=1)溶液 | 0.5mL饱和氯水 | 溶液立即变为浅红色 |
| 实验ii | 1mL15mol·L−1HNO3溶液 | 溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色 |
(4)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的
假设2:氯水氧化性强,
取实验i中浅红色溶液,
(5)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网