解答题-原理综合题 较易0.85 引用3 组卷126
试运用所学知识,研究CO等气体的性质,请回答:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g) 2CO(g) ΔH1;
2CO(g) ΔH1;
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;
③C(s)+ H2O(g) CO(g)+ H2(g) ΔH3;
CO(g)+ H2(g) ΔH3;
反应③的平衡常数表达式为K=___________ ;上述反应中ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________ 。
(2)在一定体积的密闭容器中,进行反应②: CO(g)+H2O(g) H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______
H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______
(3)不同温度下反应②的平衡常数如下表所示。则ΔH2___________ 0(填“<”“>”);
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为___________ 。
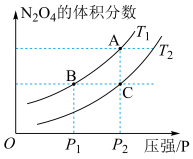
(4)对于反应2NO2(g) N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1
N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1___________ T2(填“>”或“<”);增大压强,平衡向___________ 反应方向移动;B、C两点的平衡常数B___________ C(填“>”或“<”)。
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)
②CO(g)+H2O(g)
③C(s)+ H2O(g)
反应③的平衡常数表达式为K=
(2)在一定体积的密闭容器中,进行反应②: CO(g)+H2O(g)
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
(3)不同温度下反应②的平衡常数如下表所示。则ΔH2
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)对于反应2NO2(g)

23-24高三上·广东汕头·阶段练习
类题推荐
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) ΔH= -612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ΔH= -798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为__________________________________
(2)不同温度下反应CO(g) + H2O(g) CO2(g) + H2(g) ΔH的平衡常数如下表所示。
CO2(g) + H2(g) ΔH的平衡常数如下表所示。
则ΔH______ 0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)= 0.005mol/L、c(H2)= 0.015mol/L,则CO的平衡转化率为______ 。
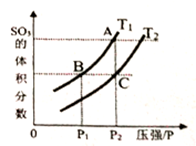
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
A. SO2和SO3浓度相等 B. 容器中混合气体的密度保持不变
C. 容器中气体的压强保持不变 D. SO3的生成速率与SO2的生成速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1______ T2 (填“>”或“<");如果想加快正反应的速率,除了改变温度,还可以用___________ 方法。
2P(s) + 3Cl2(g) = 2PCl3(g) ΔH= -612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ΔH= -798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(2)不同温度下反应CO(g) + H2O(g)
 CO2(g) + H2(g) ΔH的平衡常数如下表所示。
CO2(g) + H2(g) ΔH的平衡常数如下表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)
 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是A. SO2和SO3浓度相等 B. 容器中混合气体的密度保持不变
C. 容器中气体的压强保持不变 D. SO3的生成速率与SO2的生成速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1

(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________ .
(2)不同温度下反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
则ΔH1______ 0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______ 。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________ 。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____ T2 (填“>”或“<");理由是_____ 。如果想加快正反应的速率,除了改变温度,还可以用_______ 方法。

2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(2)不同温度下反应CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)
 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1

氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据能量变化示意图如图1,请写出NO2和CO反应的热化学方程式____ 。

(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如表:
①试判断K1____ K2(填写>、=,<)。
②下列各项能说明该反应已达到平衡状态的是____ (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示。
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示。
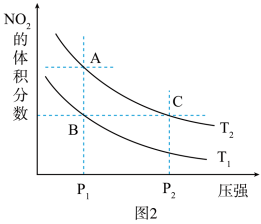
①A、C两点的反应速率:A____ C(填>、=、<)。
②A、C两点N2O4的转化率:A____ C(填>、=、<)。
③由状态B到状态A,可以采用的方法是____ 。
(4)生产水煤气的过程如下:
①C(s)+CO2(g) 2CO(g) △H1
2CO(g) △H1
②C(s)+H2O(g) CO(g)+H2(g) △H2
CO(g)+H2(g) △H2
反应CO2(g)+H2(g) CO(g)+H2O(g)△H=
CO(g)+H2O(g)△H=____ (用含△H1、△H2的代数式表示)。
(1)根据能量变化示意图如图1,请写出NO2和CO反应的热化学方程式

(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
①试判断K1
②下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g)

①A、C两点的反应速率:A
②A、C两点N2O4的转化率:A
③由状态B到状态A,可以采用的方法是
(4)生产水煤气的过程如下:
①C(s)+CO2(g)
②C(s)+H2O(g)
反应CO2(g)+H2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


