解答题-原理综合题 适中0.65 引用4 组卷657
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g)=CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为_______ 。
(2)反应①为________ (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有______ (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图象符合反应①的是______ (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
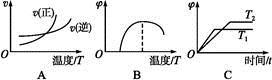
(5)由反应①和②可求得,反应2Fe(s)+O2(g)= 2FeO(s)的ΔH=________ 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式:______________________________________________ 。
反应②CO(g)+1/2O2(g)=CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为
(2)反应①为
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图象符合反应①的是

(5)由反应①和②可求得,反应2Fe(s)+O2(g)= 2FeO(s)的ΔH=
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式:
2014高三·全国·专题练习
类题推荐
反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=-akJ•mol-1,平衡常数为K;反应②CO(g)+
FeO(s)+CO(g) ΔH1=-akJ•mol-1,平衡常数为K;反应②CO(g)+ O2(g)=CO2(g) ΔH2=-bkJ•mol-1。测得在不同温度下,K值如表:
O2(g)=CO2(g) ΔH2=-bkJ•mol-1。测得在不同温度下,K值如表:
(1)若500℃时进行反应①,CO2起始浓度为2mol•L-1,CO的平衡浓度为____ 。
(2)反应①中的a____ 0(填大于、小于、等于)。
(3)700℃反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有____ (填序号)。
(4)下列图象符合反应①的是_____ (填序号)(图中φ是混合物中CO的含量,T为温度)。
A.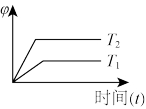 B.
B.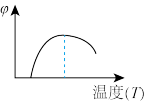 C.
C.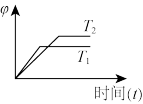
(5)反应③2Fe(s)+O2(g)=2FeO(s) ΔH3=_____ 。
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2起始浓度为2mol•L-1,CO的平衡浓度为
(2)反应①中的a
(3)700℃反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有
| A.缩小反应器体积 | B.通入CO2 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
A.
 B.
B. C.
C.
(5)反应③2Fe(s)+O2(g)=2FeO(s) ΔH3=
反应① Fe(s)+CO2(g) FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g)
FeO(s)+CO(g) +akJ;反应② CO(g)+1/2O2(g) CO2(g) +bkJ
CO2(g) +bkJ
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为________ ,a________ 0(填“大于”、“小于”或“等于”)。 在500℃2L密闭容器中进行反应①,CO2起始量为4mol,其转化率为50%,则CO的平衡浓度为________ 。
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有______ (填序号)。
A 缩小反应器体积 B 通入CO2 C 升高温度到900℃ D 使用合适的催化剂
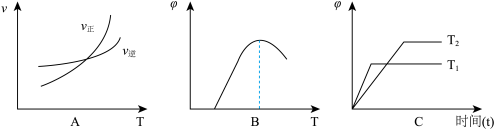
(3)下列图象符合反应①的是________ (填序号)(图中v是速率、 为混合物中CO含量,T为温度且T1>T2)。
为混合物中CO含量,T为温度且T1>T2)。
(4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
2FeO(s)+Q 的Q=__________ 。
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)反应①的化学平衡常数表达式为
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
A 缩小反应器体积 B 通入CO2 C 升高温度到900℃ D 使用合适的催化剂
(3)下列图象符合反应①的是

(4)由反应①和②可求得,反应2Fe(s)+O2(g)
已知反应Fe(s)+CO2(g) FeO(s)+CO(g) △H=akJ/mol ,测得在不同温度下,反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) △H=akJ/mol ,测得在不同温度下,反应的平衡常数K随温度的变化如下:
(1)若 时进行该反应,CO2起始浓度为2mol/L,CO的平衡浓度为
时进行该反应,CO2起始浓度为2mol/L,CO的平衡浓度为__________ 。
(2)反应中的a__________ (填“大于”“小于”或“等于”)0。
(3) 反应达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有
反应达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有__________ (填序号)。
A.缩小反应器体积
B.通入CO2
C.升高温度到
D.使用合适的催化剂
(4)下列图象符合反应的是__________ (填序号)。(图中v是速率、 为混合物中CO含量,T为温度且
为混合物中CO含量,T为温度且 )
)

 FeO(s)+CO(g) △H=akJ/mol ,测得在不同温度下,反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) △H=akJ/mol ,测得在不同温度下,反应的平衡常数K随温度的变化如下:| 温度/℃ | 500 | 700 | 900 |
| K |
(1)若
(2)反应中的a
(3)
A.缩小反应器体积
B.通入CO2
C.升高温度到
D.使用合适的催化剂
(4)下列图象符合反应的是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


