填空题 适中0.65 引用1 组卷41
回答下列问题。
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
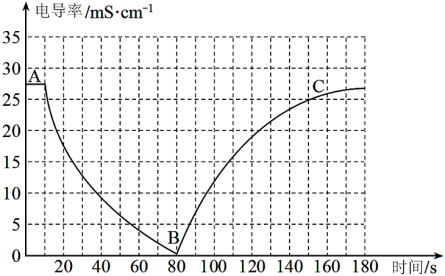
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________ ;
(2)AB段发生的反应的离子方程式是___________ ;
(3)BC段电导率逐渐上升的原因是___________ ;
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因___________ 。
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O___________ ,被氧化与被还原的硫原子数目之比是___________ 。
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O___________ ,氧化剂与还原剂个数之比为___________ ,浓盐酸表现出的性质是___________ 。
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O___________
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O___________
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。

(1)Ba(OH)2在水中以离子形式存在的实验证据是
(2)AB段发生的反应的离子方程式是
(3)BC段电导率逐渐上升的原因是
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
| A.上方 | B.下方 | C.重合 | D.无法确定 |
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O
23-24高一上·宁夏石嘴山·阶段练习
类题推荐
某兴趣小组的同学向一定体积的 溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
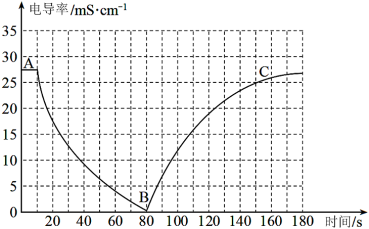
(1)上图中A、B、C中,表示 导电的是
导电的是_______ (填A、B、C);
(2)A~B段发生的离子方程式是_______ ;
(3)B~C段电导率逐渐上升的原因是_______ ;
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的_______(填选项)。
(5)如果将稀硫酸改为 溶液,反应至
溶液,反应至 恰好沉淀完全,此时溶液显
恰好沉淀完全,此时溶液显_______ 性(填“酸”、“中”或“碱”);反应的离子方程式为:_______ 。
(6)这兴趣小组通过查阅资料了解到 是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因
是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因_______ 。

(1)上图中A、B、C中,表示
(2)A~B段发生的离子方程式是
(3)B~C段电导率逐渐上升的原因是
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的_______(填选项)。
| A.上方 | B.下方 | C.重合 | D.无法确定 |
(6)这兴趣小组通过查阅资料了解到
为了探究离子反应的本质,某兴趣小组的同学向0.2mol•L-1的Ba(OH)2溶液中逐滴加入0.1mol•L-1的稀盐酸,并用电导率传感器测得混合溶液的导电能(电导率)随时间变化的曲线如图所示。试回答下列问题:
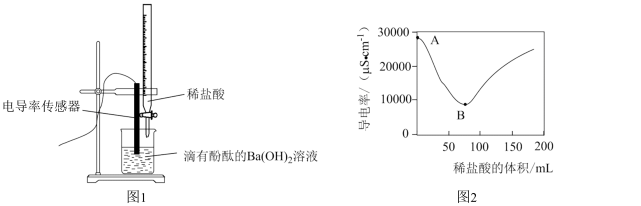
(1)Ba(OH)2溶液和稀盐酸反应的化学方程式为____ ;溶液的导电性由溶液中____ 和____ 决定。
(2)从A点到B点,下列说法中错误的是____ (单选,填标号)。
(3)B点时,溶液中的溶质是____ (填化学式)。
(4)如果将稀盐酸改为等浓度的稀硫酸,猜想此时电导率的最低点在B点的____ (填标号)。
a.上方 b.下方 c.重合 d.无法确定
(5)向Ba(OH)2溶液中通入CO2生成碳酸钡沉淀的离子方程式为____ 。
(6)用X射线检查肠胃病时,让病人服用的“钡餐”就是硫酸钡的悬浊液,但不会引起钡离子中毒。若误食碳酸钡,则会出现钡离子中毒现象。请用离子方程式解释不能服用碳酸钡的原因:____ 。

(1)Ba(OH)2溶液和稀盐酸反应的化学方程式为
(2)从A点到B点,下列说法中错误的是
| A.AB段溶液的导电能力减弱,说明电解质逐渐转变为非电解质 |
| B.溶液中Ba2+的数目没有改变 |
| C.溶液中OH-的数目不断减小 |
| D.发生反应的离子方程式是H++OH-=H2O |
(4)如果将稀盐酸改为等浓度的稀硫酸,猜想此时电导率的最低点在B点的
a.上方 b.下方 c.重合 d.无法确定
(5)向Ba(OH)2溶液中通入CO2生成碳酸钡沉淀的离子方程式为
(6)用X射线检查肠胃病时,让病人服用的“钡餐”就是硫酸钡的悬浊液,但不会引起钡离子中毒。若误食碳酸钡,则会出现钡离子中毒现象。请用离子方程式解释不能服用碳酸钡的原因:
宏观辨识、微观探析和符号表征是化学学习的重要方法。为了探究离子反应的本质,某兴趣小组的同学向 溶液中逐滴加入
溶液中逐滴加入 盐酸,并用电导率传感器测得混合溶液的导电能(电导率)随时间变化的曲线如图所示。回答下列问题:
盐酸,并用电导率传感器测得混合溶液的导电能(电导率)随时间变化的曲线如图所示。回答下列问题:

(1) 的电离方程式为
的电离方程式为_______ 。
(2)从A点到B点,下列说法错误的是_______(单选,填标号)。
(3)B点时,溶液中的溶质是_______ (填化学式)。
(4)下列各项反应的本质与“ 溶液和稀盐酸反应的本质”相同的是_______(填标号)。
溶液和稀盐酸反应的本质”相同的是_______(填标号)。
(5)如果将稀盐酸改为等浓度的稀硫酸,猜想此时电导率的最低点在B点的_______ (填标号)。
a.上方 b.下方 c.重合 d.无法确定
(6)用X射线检查肠胃病时,让病人服用的“钡餐”就是硫酸钡的悬浊液,但不会引起钡离子中毒。若误食碳酸钡,则会出现钡离子中毒现象。请用离子方程式解释不能服用碳酸钡的原因_______ 。

(1)
(2)从A点到B点,下列说法错误的是_______(单选,填标号)。
| A.AB段溶液的导电能力减弱,说明电解质逐渐转变为非电解质 |
| B. |
| C. |
| D.发生的离子反应是 |
(4)下列各项反应的本质与“
| A. | B. |
| C. | D. |
a.上方 b.下方 c.重合 d.无法确定
(6)用X射线检查肠胃病时,让病人服用的“钡餐”就是硫酸钡的悬浊液,但不会引起钡离子中毒。若误食碳酸钡,则会出现钡离子中毒现象。请用离子方程式解释不能服用碳酸钡的原因
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


