解答题-原理综合题 适中0.65 引用3 组卷920
甲酸甲酯(HCOOCH3)是一种重要的有机合成中间体,可通过甲醇催化脱氢法制备,其工艺过程包含以下反应:
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g) K1,△H1=+51.2kJ•mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g) K2,△H2=+90.1kJ•mol-1
回答下列问题:
(1)反应HCOOCH3(g)=2CO(g)+2H2(g)的△H3=________ kJ•mol-1,K3=________ (用K1、K2表示)。
(2)对于反应Ⅰ:增大压强,平衡________ 移动(填“向左”“向右”或“不”)。保持压强不变,要缩短反应达到平衡的时间,可采取的措施是________ 、________ 。
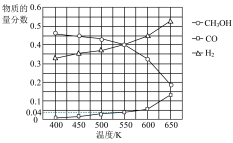
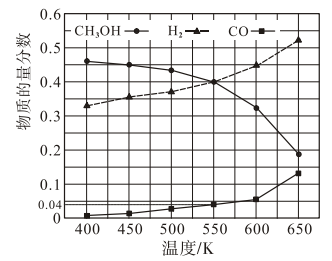
(3)在400kPa、铜基催化剂存在下,向密闭容器中通入CH3OH进行Ⅰ、Ⅱ两个反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
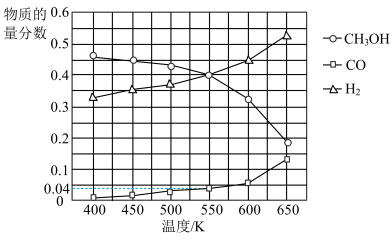
①随温度升高,CH3OH的平衡组成比例呈现如图所示趋势的原因是________ 。
②550K时,反应2CH3OH(g)=HCOOCH3(g)+2H2(g)的平衡常数Kp=________ kPa,CH3OH的平衡转化率为________ 。
③研究表明,在700K以后升高体系温度,HCOOCH3的产率下降,可能的原因是________ 。
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g) K1,△H1=+51.2kJ•mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g) K2,△H2=+90.1kJ•mol-1
回答下列问题:
(1)反应HCOOCH3(g)=2CO(g)+2H2(g)的△H3=
(2)对于反应Ⅰ:增大压强,平衡
(3)在400kPa、铜基催化剂存在下,向密闭容器中通入CH3OH进行Ⅰ、Ⅱ两个反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①随温度升高,CH3OH的平衡组成比例呈现如图所示趋势的原因是
②550K时,反应2CH3OH(g)=HCOOCH3(g)+2H2(g)的平衡常数Kp=
③研究表明,在700K以后升高体系温度,HCOOCH3的产率下降,可能的原因是
2023·四川绵阳·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网