解答题-实验探究题 适中0.65 引用1 组卷126
在初中化学“金属的性质”中有如下实验:将无锈铁钉没入 溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和 溶液也能发生化学反应吗?
溶液也能发生化学反应吗?
(1)预测Al能和
 溶液反应,理由是
溶液反应,理由是___________ 。
【进行实验】将一端缠绕的铝丝浸入 溶液(如图),观察现象。
溶液(如图),观察现象。
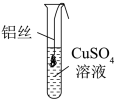
(2)铝丝表面未出现红色物质,原因是___________ (用化学方程式解释)。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入 溶液,观察现象。
溶液,观察现象。
(3)填写实验报告单:
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:① 呈蓝绿色,不溶于水;②
呈蓝绿色,不溶于水;② 可加快铝丝和其他物质的反应速率。
可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为___________ 。
(5)欲加快Al和
 溶液的反应,可加入的物质是
溶液的反应,可加入的物质是___________ (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是___________(填序号)。
【提出问题】Al和
(1)预测Al能和
【进行实验】将一端缠绕的铝丝浸入

(2)铝丝表面未出现红色物质,原因是
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入
(3)填写实验报告单:
| 序号 | 实验现象 | 结论与解释 |
| ① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 | |
| ② | 红色物质是 | |
| ③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色;两层溶液界面清晰 | 反应生成的 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为
(5)欲加快Al和
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是___________(填序号)。
| A.食醋 | B.食用油 | C.面粉 | D.咸菜 |
23-24高一上·安徽安庆·阶段练习
类题推荐
铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为______ 。实验前,需要对铝的表面先进行______ (填操作)处理。兴趣小组同学将铝处理好后剪成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验一的现象为_____ 。
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为____ 。实验三表明,铝的金属活动性____ (填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:____ 。为验证猜想①是否合理,应在铝和稀硫酸中加入____ (填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
Ⅱ.测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
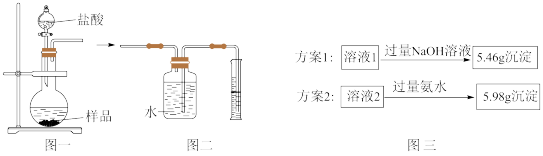
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。_____ 。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是_____ 。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为
(2)铝和酸、碱、盐溶液的反应
| 实验 | 操作 | 现象 | 结论 |
| 一 | 将铝片放入稀盐酸中 | ,试管变烫 | 铝能与盐酸发生反应,反应放热 |
| 二 | 将铝片放入氢氧化钠溶液中 | 铝表面有气泡产生试管变烫 | 铝能与氢氧化钠溶液反应,反应放热 |
| 三 | 将铝放入硫酸铜溶液中 | 铝表面有红色物质产生,溶液逐渐变成无色 | 金属活动性:铝 铜 |
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:
A.Na2SO4 B.Na2CO3 C.NaCl
Ⅱ.测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。

①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是
某学习小组用下图装置探究 与CuO的反应。
与CuO的反应。
查阅资料:
i. 溶液中存在平衡:
溶液中存在平衡:
ⅱ.相关物质的性质
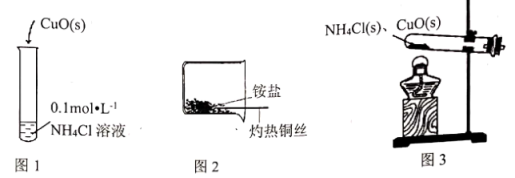
(1)实验Ⅰ:如图1,一段时间后,固体部分溶解,固体表面无颜色变化,溶液变为蓝色。固体溶解的原因是_______ 。
(2)实验Ⅱ:如图2,将铜丝加热变黑后迅速插入疏松的氯化铵固体中,有白烟生成,2分钟后取出铜丝,黑色消失变回红色。
①已知氯化铵与氧化铜反应生成两种单质,其中一种为无色气体,写出该反应的化学方程式_______ 。
②若将氯化铵换为硫酸铵,观察不到上述现象,原因是_______ 。
(3)实验Ⅲ:如图3,加热试管,管内产生白烟,黑色混合物熔化、流动,持续加热15分钟,原黑色固体混合物变为暗红色。取暗红色固体进行下列实验:
根据现象推测白色沉淀可能是_______ (填化学式),该物质与浓硝酸反应的离子方程式为_______ 。
(4)实验Ⅰ、Ⅱ、Ⅲ现象不同的可能原因是_______ 。(写2点)

查阅资料:
i.
ⅱ.相关物质的性质
| 物质 | 固体颜色 | 水溶液颜色 |
| 棕色 | 蓝绿色 | |
| 深蓝色 | 深蓝色 | |
| 白色 | 不溶于水 |
(2)实验Ⅱ:如图2,将铜丝加热变黑后迅速插入疏松的氯化铵固体中,有白烟生成,2分钟后取出铜丝,黑色消失变回红色。
①已知氯化铵与氧化铜反应生成两种单质,其中一种为无色气体,写出该反应的化学方程式
②若将氯化铵换为硫酸铵,观察不到上述现象,原因是
(3)实验Ⅲ:如图3,加热试管,管内产生白烟,黑色混合物熔化、流动,持续加热15分钟,原黑色固体混合物变为暗红色。取暗红色固体进行下列实验:
| 序号 | 加入试剂 | 现象 |
| i | 水 | 产生白色沉淀,一段时间后沉淀的颜色转变为蓝色、绿色、蓝绿色等 |
| ii | 浓硝酸 | 激烈反应,产生大量红棕色气体,溶液变为深蓝绿色 |
(4)实验Ⅰ、Ⅱ、Ⅲ现象不同的可能原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



