解答题-实验探究题 较难0.4 引用1 组卷83
三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为
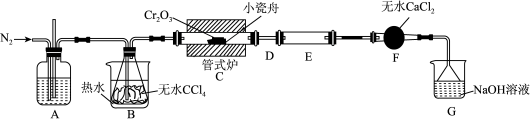
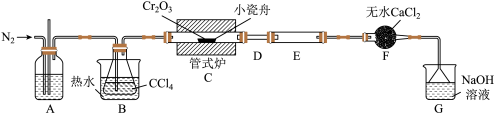
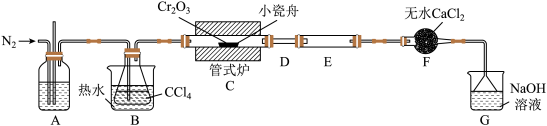
的反应为 ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 (黄色):酸性条件下,
(黄色):酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
(1)A装置用于干燥 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是___________ ;无水
 的作用是
的作用是___________ ;反应结束后要继续通入一段时间氮气,主要目的是___________ 。
(2)装置E用来收集产物。实验过程中D不合理,D应如何改进并说明改进的原因___________ 。
(3)尾气与装置G中过量的NaOH溶液发生反应的离子方程式是___________ 。
(4)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
Ⅰ.取mg 产品,在强碱性条件下,加入过量30%
产品,在强碱性条件下,加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的Cmol⋅L
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的Cmol⋅L
 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液VmL(滴定中
标准溶液VmL(滴定中 被
被 还原为
还原为 )。
)。
产品中 质量分数表达式为
质量分数表达式为___________ %。

已知:①
②碱性条件下,
(1)A装置用于干燥
(2)装置E用来收集产物。实验过程中D不合理,D应如何改进并说明改进的原因
(3)尾气与装置G中过量的NaOH溶液发生反应的离子方程式是
(4)测定产品中
Ⅰ.取mg
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使
Ⅲ.在溶液中加入适量浓
产品中
23-24高三上·河南商丘·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网