填空题 适中0.65 引用1 组卷428
Ⅰ.甲醇脱氢法制
反应a:
反应b:
反应c:
(1)
(2)一定条件下,在容积为10L的恒容密闭容器中通入
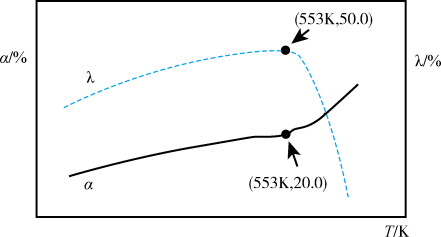
①553K时,体系中
②当温度高于553K时,
A.升高温度使催化剂活性降低
B.升高温度使反应a逆向移动
C.反应a平衡常数减小
D.温度升高反应b速率加快
E.温度升高反应c速率加快
Ⅱ.在一定条件下可利用甲醇羰基化法制甲酸甲酯,其反应原理可表示为:
(3)向体积为2L的密闭容器中充入
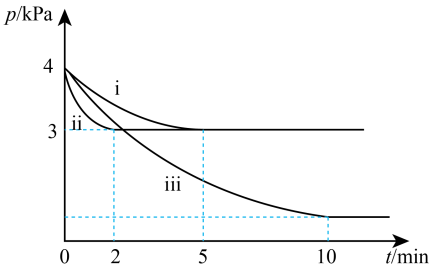
①ⅱ和ⅰ相比,改变的反应条件是
②反应ⅱ在2min时达到平衡,平衡常数
③反应ⅰ的温度
2023·陕西渭南·模拟预测
类题推荐
HCOOCH3是一种重要的化工产品,被公认为“万能中间体”。甲醇脱氢法制HCOOCH3是工业上的一种重要方法,具有工艺流程短、原料单一、反应条件温和等优点。其工艺过程涉及如下反应:
反应I: 2CH3OH(g) HCOOCH3(g) + 2H2(g) △H1=+135.4 kJ·mol-1
HCOOCH3(g) + 2H2(g) △H1=+135.4 kJ·mol-1
反应Ⅱ: CH3OH(g) CO(g) + 2H2(g) △H2=+106.0 kJ·mol-1
CO(g) + 2H2(g) △H2=+106.0 kJ·mol-1
一定条件下,在容积为10L的恒容密闭容器中通入1.0molCH3OH气体发生上述反应,在不同温度下连续反应4h。测得甲醇的总转化率(α,图中实线表示)和HCOOCH3的选择性(λ,图中虚线表示)随温度变化如图所示。(已知: HCOOCH3的选择性= ),下列说法正确的是
),下列说法正确的是

反应I: 2CH3OH(g)
反应Ⅱ: CH3OH(g)
一定条件下,在容积为10L的恒容密闭容器中通入1.0molCH3OH气体发生上述反应,在不同温度下连续反应4h。测得甲醇的总转化率(α,图中实线表示)和HCOOCH3的选择性(λ,图中虚线表示)随温度变化如图所示。(已知: HCOOCH3的选择性=

| A.温度超过553K后,反应I平衡逆向移动 |
| B.553K 下,HCOOCH3的产量为0.1mol |
| C.反应Ⅲ: HCOOCH3(g) |
| D.其他条件不变,随着温度升高,出口处HCOOCH3、H2、CO的量均不断增大 |
研发CO2利用技术、降低空气中CO2含量可采用“CO2催化加氢制甲醇”方法。
该反应体系中涉及以下两个反应:
Ⅰ.
Ⅱ.
回答下列问题:
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(2)反应Ⅰ、Ⅱ的InK(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
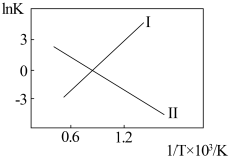
试判断升高温度,反应 的化学平衡常数
的化学平衡常数___________ (填“增大”或“减小”或“不变”)。
(3)恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
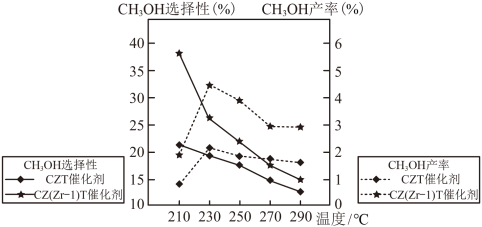
其中:CH3OH的选择性
①在上述条件下合成甲醇的工业条件是___________ 。
A.210℃ B.230℃ C.催化ZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是___________ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应Ⅰ和反应Ⅱ,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则反应Ⅱ的平衡常数K=___________ (保留两位有效数字)。
(5)已知对于反应Ⅰ, ,
, 。其中
。其中 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。
分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。
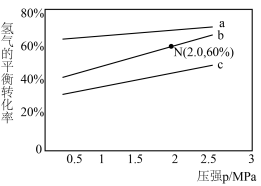
①比较a、b、c各曲线所表示的投料比大小顺序为___________ (用字母表示)。
②计算540K的压强平衡常数
___________ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 ,
, ,
, ,此时
,此时
___________ 。
该反应体系中涉及以下两个反应:
Ⅰ.
Ⅱ.
回答下列问题:
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO的浓度,反应Ⅰ的平衡向正反应方向移动 |
| B.降低温度,反应Ⅰ和Ⅱ的正、逆反应速率都减小 |
| C.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
| D.增大压强,反应Ⅰ和Ⅱ重新达到平衡的时间不同 |

试判断升高温度,反应
(3)恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化ZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应Ⅰ和反应Ⅱ,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则反应Ⅱ的平衡常数K=
(5)已知对于反应Ⅰ,

①比较a、b、c各曲线所表示的投料比大小顺序为
②计算540K的压强平衡常数
③540K条件下,某容器测得某时刻
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



