填空题 适中0.65 引用1 组卷66
甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g) △H。在体积可变的密闭容器中投入0.5molCO和0.75molH2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
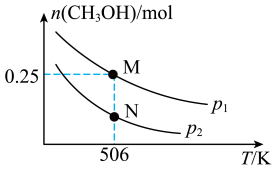
(1)根据图象判断△H_______ 0(填“<”或“>”);M点H2的转化率为_______ 。
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的_______ (填字母序号)。
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率_______ (填“增大”、“不变”或“减小”)。

(1)根据图象判断△H
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=
(3)下列叙述能说明上述反应达到化学平衡状态的
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率
22-23高二上·北京朝阳·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网