解答题-原理综合题 适中0.65 引用1 组卷26
能源开发和利用是科学研究的热点课题。
(1)几个有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ.

Ⅱ.

Ⅲ.

则

______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)在1L恒容密闭容器中充入一定量 发生反应:
发生反应:
 ,测得
,测得 的浓度与温度的关系如图所示:
的浓度与温度的关系如图所示:
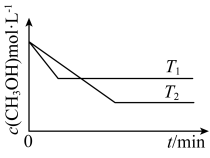
①
______ (填“>”“<”或“=”)0,说明理由______ 。
②在 时达到平衡后,再向容器中充入少量甲醇蒸气,
时达到平衡后,再向容器中充入少量甲醇蒸气, 的平衡转化率
的平衡转化率______ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成 的反应表示如下:
的反应表示如下:
 ,向1L的恒容密闭容器中加入
,向1L的恒容密闭容器中加入
 和
和
 在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为
在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为 。
。
①从反应开始恰好平衡状态时, 的平均反应速率
的平均反应速率 为
为______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入
 和
和
 时,平衡
时,平衡______ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究 合成反应化学平衡的影响因素,有利于提高
合成反应化学平衡的影响因素,有利于提高 的产率。以
的产率。以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入
 和
和
 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为
为 ,
, 为
为 ,此时
,此时 的浓度为
的浓度为______  (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。
(1)几个有关
Ⅰ.
Ⅱ.
Ⅲ.
则
(2)在1L恒容密闭容器中充入一定量

①
②在
(3)工业上,利用水煤气合成
①从反应开始恰好平衡状态时,
②在温度不变条件下,上述反应达到平衡后再向容器中充入
(4)探究
Ⅰ.
Ⅱ.
Ⅲ.
一定条件下,向体积为
23-24高二上·辽宁·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网