填空题 较易0.85 引用1 组卷63
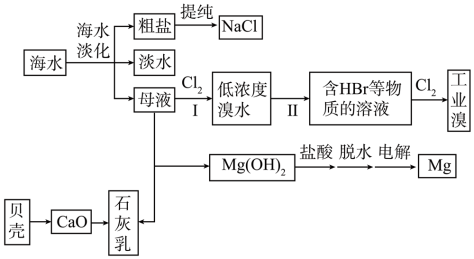
随着科学技术的不断发展,可以通过淡化海水获取淡水、从海水中提取食盐、镁等重要的化学物质。
(1)某海水样品测得其pH值约为8.0~8.5(常温下),以下物质中,可能使海水呈碱性的有_____(填字母)。
(2)在浓氨水中通入过量 后,加入
后,加入 颗粒可制得碳酸氢钠,写出另一产物的电子式
颗粒可制得碳酸氢钠,写出另一产物的电子式_____ 。
(3)常温下,将盐酸和氨水混合,所得溶液 ,此时溶液中
,此时溶液中
_____  (填字母)。
(填字母)。
A.> B.< C.=
(4)碳酸钠和碳酸氢钠是两种非常重要的化工产品,下列关于两种物质的水溶液的说法错误的是_____(填字母)。
(5)海水淡化的方法主要有两种原理,除了可以利用反渗透膜的分离作用淡化海水,还可以利用_____(填字母)原理,进行海水淡化。
(1)某海水样品测得其pH值约为8.0~8.5(常温下),以下物质中,可能使海水呈碱性的有_____(填字母)。
| A. | B. | C. | D. |
(3)常温下,将盐酸和氨水混合,所得溶液
A.> B.< C.=
(4)碳酸钠和碳酸氢钠是两种非常重要的化工产品,下列关于两种物质的水溶液的说法错误的是_____(填字母)。
| A.两种溶液之间不能相互转化 |
| B.均存在水解平衡 |
| C.均呈碱性,且加热后碱性都增强 |
| D.均存在 |
| A.过滤 | B.蒸馏 | C.渗析 | D.萃取。 |
23-24高三上·上海宝山·阶段练习
类题推荐
我国海洋资源十分丰富。随着科学技术的不断发展,可以通过淡化海水获取淡水、从海水中提取食盐、镁等重要的化学物质。镁是重要的国防金属,世界上60%的镁是从海水中提取的,下图是海水提镁的流程图:
(1)试剂a可以为___________ (填“CaO”或“CaCO3”),该物质属于___________ 。
A.强电解质 B.非电解质 C.弱电解质 D.离子化合物
(2)上述流程中,由氯化镁溶液得到无水氯化镁的过程是将氯化镁溶液蒸发浓缩、冷却结晶,得到MgCl2·6H2O,后将该晶体在X气流中加热得到无水MgCl2,则X物质可能为___________。
(3)写出氢氧化镁和试剂b反应的离子方程式___________ 。
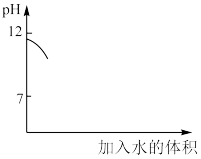
(4)常温下,取氢氧化镁悬浊液,加一定量的水进行稀释(稀释后仍为悬浊液),在下图中补全稀释过程中pH值随加入水的体积的变化示意图。___________
(5)在氢氧化镁悬浊液中加入CuSO4,现象为___________ ,写出该过程中的化学反应原理___________ 。(已知 、
、 )。
)。

(1)试剂a可以为
A.强电解质 B.非电解质 C.弱电解质 D.离子化合物
(2)上述流程中,由氯化镁溶液得到无水氯化镁的过程是将氯化镁溶液蒸发浓缩、冷却结晶,得到MgCl2·6H2O,后将该晶体在X气流中加热得到无水MgCl2,则X物质可能为___________。
| A.Cl2 | B.N2 | C.HCl | D.CO2 |
(4)常温下,取氢氧化镁悬浊液,加一定量的水进行稀释(稀释后仍为悬浊液),在下图中补全稀释过程中pH值随加入水的体积的变化示意图。

(5)在氢氧化镁悬浊液中加入CuSO4,现象为
一般来说,较强酸可以制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1 mol·L−1的下列6种溶液的pH。
(1)①请根据上述信息判断下列反应不能发生的是____ (填字母)。
A.CH3COOH+NaCN=CH3COONa+HCN
B.CO2+H2O+2NaClO=Na2CO3+2HClO
C.2HCN+Na2CO3=2NaCN+CO2↑+H2O
D.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A−=B2−+2HA,则A−、B2−、HB−三种阴离子结合H+的难易顺序为________ 。
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液;②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体;③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。根据上述反应,总结出复分解反应发生的另一规律为_______________ 。
(3)常温下将某电解质溶解在水中后,溶液中的c(H+)=10−9 mol·L−1,则该电解质可能是____ (填字母)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(4)常温下,将a L pH=3的盐酸分别与下列三种溶液混合,所得溶液均呈中性。
①b L浓度为1.0×10−3 mol·L−1的氨水;
②c L c(OH−)=1.0×10−3 mol·L−1的氨水;
③d L c(OH−)=1.0×10−3 mol·L−1的氢氧化钠溶液。
则a、b、c、d的大小关系:__________ 。
(5)一定温度下,等体积、等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa,分别加入等量的水,pH变化最小的是____ (填序号)。一定温度下,向等体积的纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1 (填“>”、“<”或“=”)n2。
(6)已知常温时Ksp(AgCl)=1.8×10−10,向50 mL 0.018 mol·L−1的AgNO3溶液中加入相同体积0.02 mol·L−1的盐酸,则c(Ag+)=____ ,此时所得混合溶液的pH=____ 。(忽略溶液混合时体积的变化)
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN=CH3COONa+HCN
B.CO2+H2O+2NaClO=Na2CO3+2HClO
C.2HCN+Na2CO3=2NaCN+CO2↑+H2O
D.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A−=B2−+2HA,则A−、B2−、HB−三种阴离子结合H+的难易顺序为
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液;②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体;③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。根据上述反应,总结出复分解反应发生的另一规律为
(3)常温下将某电解质溶解在水中后,溶液中的c(H+)=10−9 mol·L−1,则该电解质可能是
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(4)常温下,将a L pH=3的盐酸分别与下列三种溶液混合,所得溶液均呈中性。
①b L浓度为1.0×10−3 mol·L−1的氨水;
②c L c(OH−)=1.0×10−3 mol·L−1的氨水;
③d L c(OH−)=1.0×10−3 mol·L−1的氢氧化钠溶液。
则a、b、c、d的大小关系:
(5)一定温度下,等体积、等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa,分别加入等量的水,pH变化最小的是
(6)已知常温时Ksp(AgCl)=1.8×10−10,向50 mL 0.018 mol·L−1的AgNO3溶液中加入相同体积0.02 mol·L−1的盐酸,则c(Ag+)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网