解答题-原理综合题 适中0.65 引用1 组卷39
2021年以来,全国十六个省市将氢能源写入“十四五”规划中,氢能是助力“碳达峰、碳中和”战略目标实现的重要新能源,以CH4为原料制H2具有广阔的应用前景。在一定条件下CH4与CO2催化重整制 涉及以下反应:
涉及以下反应:
主反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+248 kJ·mol-1
2CO(g)+2H2(g) △H1=+248 kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41 kJ·mol-1
CO(g)+H2O(g) △H2=+41 kJ·mol-1
(1)写出CH4与H2O反应生成CO和H2的热化学方程式___________ 。
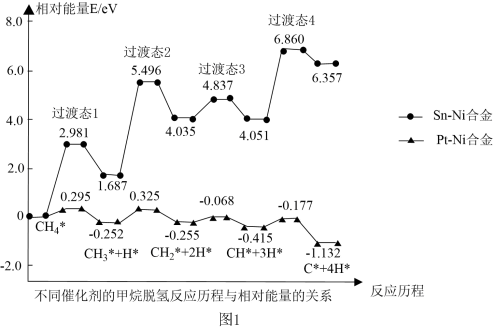
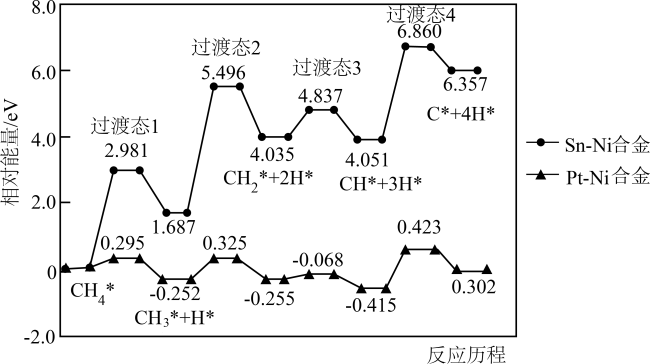
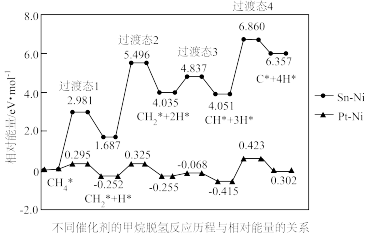
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。
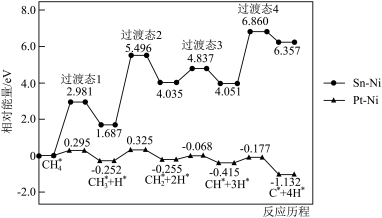
使用Sn-Ni合金作为催化剂的历程中最大能垒
___________ eV;脱氢反应阶段选择Pt-Ni合金作为催化剂效果更好,理由是___________ 。
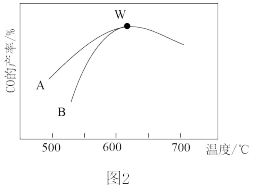
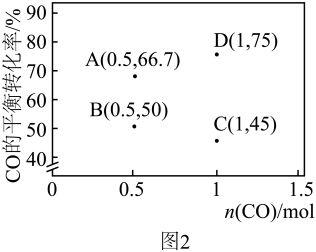
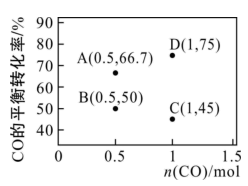
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线___________ (填“A”或“B”)表示CO2的平衡转化率。
②X点的速率:v(正)___________ v(逆)(填“>”“<”或“=”)。
③800 K时,主反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
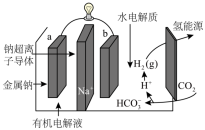
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为___________ 。
主反应:CH4(g)+CO2(g)
副反应:CO2(g)+H2(g)
(1)写出CH4与H2O反应生成CO和H2的热化学方程式
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。

使用Sn-Ni合金作为催化剂的历程中最大能垒
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线
②X点的速率:v(正)
③800 K时,主反应的平衡常数Kp=
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为

23-24高二上·湖北宜昌·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网